
题目列表(包括答案和解析)
(1)在200℃、101 kPa时,1 g H2与碘蒸气完全反应放出7.45 kJ的热量,请写出该反应的热化学方程式________.
(2)在1×105 Pa和298 K时,将拆开1 mol共价键所需要的能量称为键能(kJ/mol).下面是一些共价键的键能:
在298 K时,在催化剂存在下,H2(g)+Cl2(g)=2HCl(g) ΔH=________kJ/mol
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-116 kJ·mol-1
CH3OH(g) ΔH1=-116 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:
________.
(4)N2(g)+3H2(g)![]() 2NH3(g)反应过程的能量变化如图所示.已知2 mol N2(g)反应生成4 mol NH3(g)放出-188.4 kJ/mol.则:
2NH3(g)反应过程的能量变化如图所示.已知2 mol N2(g)反应生成4 mol NH3(g)放出-188.4 kJ/mol.则:
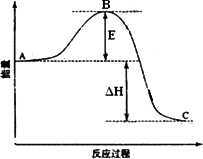
图中E的大小对该反应的反应热有无影响?________.(填“有影响”或“无影响”).该反应通常用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?________(填“升高”或“降低”).图中ΔH=________kJ/mol.对于达平衡后的该反应,若只改变下列条件之一,能使单位体积内活化分子百分数增加的是________.
A.升温
B.再充入N2和H2,并使它们的浓度都增加一倍
C.减压
D.加催化剂
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2![]() 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下: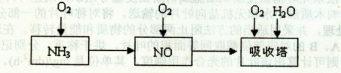
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B. |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

 2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)
2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号) 2NH3(g)
2NH3(g)  。
。  ,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。
,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。  2NO2(g)
2NO2(g)  。该反应的反应速率(
。该反应的反应速率(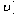 )随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。
)随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。 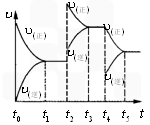
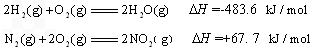
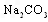 溶液吸收NO2生成CO2。若
溶液吸收NO2生成CO2。若 和
和 溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。
溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com