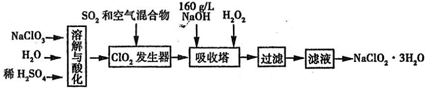
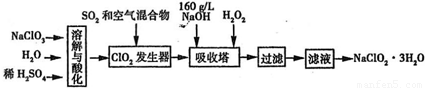
亚氯酸钠(NaClO
2)是一种重要的消毒剂.已知:①NaClO
2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO
2?3H
2O,②ClO
2的沸点为283K,纯ClO
2易分解爆炸,③HClO
2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸.如图是过氧化氢法生产亚氯酸钠的工艺流程图:

(1)C1O
2发生器中所发生反应的离子方程式为______,发生器中鼓入空气的作用可能是______(选填序号).
A.将SO
2氧化成SO
3增强酸性 B.稀释C1O
2以防止爆炸 C.将NaClO
3氧化成C1O
2(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是______g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有______.
(3)在碱性溶液中NaClO
2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是______.
(4)在吸收塔中,可代替H
2O
2的试剂是______ (填序号).
A.Na
2O
2 B.Na
2S C.FeCl
2 D.KMnO
4(5)从滤液中得到NaClO
2?3H
2O晶体的实验操作依次是______(填操作名称)