
题目列表(包括答案和解析)
最新选择题专项训练
2005年2月18日英国食品标准署就食用含有添加苏丹红色素的食品可能诱发癌症向消费者发出警告。我国也已开始追查含苏丹红色素的食品。所谓“苏丹红一号”实际上一般称为“苏丹一号”,是一种黄溶剂染料,按化学染料分类称为溶剂黄14(C.L.Solvent,Yellow14),分子式为C16H12N2O,其化学结构属偶氮类染料,是由苯胺重氮化后与2-萘酚偶合制得。有关苏丹红一号下列说法正确的是( )
A.苏丹红一号在食品中能起到增色的作用,可在辣椒酱中用作添加剂
B.苏丹红一号的摩尔质量为248
C.苏丹红一号可用于溶解剂、机油、蜡和鞋油等产品的染色
D.食品添加剂对人体危害较大,因此应全面禁止使用。
NA为阿佛加德罗常数,下述正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
在pH =1的无色溶液中能大量共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
拟除虫菊酯是一类高效、低毒、对昆虫具有强
烈触杀作用的杀虫剂,其中对光稳定的溴氰
菊酯的结构简式如右图:
下列对该化合物叙述正确的是( )
A.属于芳香烃 B.属于卤代烃
C.在酸性条件下不水解 D.在一定条件下可以发生加成反应
可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个反应 ①Br2+2e=2Br-②2Br—2e=Br2③Zn-2e=Zn2+④Zn2++2e=Zn其中表示充电时的阳极反应和放电时的负极反应的是
A ②和③ B ②和① C ③和① D ④和①
NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A 跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
下列实验过程中产生的现象与对应的图形相符合的是
A NaHSO3粉末加入HNO3溶液中 B H2S气体通入氯水中


C NaOH溶液滴入Ba(HCO3)2溶液中 D CO2气体通入澄清石灰水中


是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )

A 1︰1 B 2︰1 C 1︰2 D 2︰3
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A 可以和溴水反应 B 可用有机溶剂萃取
C 分子中有三个苯环 D 1mol维生素P可以和4molNaOH反应
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
A、 B、
B、
C、 D、
D、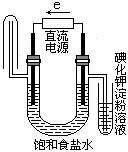
CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同。以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A、将两种样品分别溶于硝酸,区别所产生的气体
B、将两种样品分别溶于硝酸,区别溶液的颜色
C、取两种同质量的样品分别在高温中灼烧,区别残留固体的质量
D、取两种同质量的样品分别在高温中灼烧,区别残留固体的颜色
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A、0.1 mol B、0.2 mol C、0.3 mol D、0.4 mol
下列各组气体或溶液用括号试剂加以鉴别,其中不合理的是
A、二氧化碳、二氧化硫、一氧化碳(品红溶液)B、酒精、醋酸、醋酸钠(石蕊试液
C、氯化钠、硝酸银、碳酸钠(稀盐酸) D、硫酸、硝酸钡、氯化钾(碳酸钠溶液)
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
![]() 实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
![]() 实验二:取上述实验一后锥形瓶中清液,进行如下实验:
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
![]() (1)该清液滴在有色布条上有极强的漂白作用。(2)该清液中滴加碳酸钠溶液产生白色沉淀。(3)该清液中滴加盐酸可产生大量气体。(4)该清液加热后变浑浊并产生大量气体。
(1)该清液滴在有色布条上有极强的漂白作用。(2)该清液中滴加碳酸钠溶液产生白色沉淀。(3)该清液中滴加盐酸可产生大量气体。(4)该清液加热后变浑浊并产生大量气体。
![]()
 实验三:该学生设想用下列装置收集实验二中产生的气体作进一步检验。
实验三:该学生设想用下列装置收集实验二中产生的气体作进一步检验。
![]() 回答下列问题:
回答下列问题:
![]() (1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有 (写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有 离子;清液中滴加盐酸产生的气体是 ;清液加热后产生浑浊的原因是因为生成了 物质。
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有 (写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有 离子;清液中滴加盐酸产生的气体是 ;清液加热后产生浑浊的原因是因为生成了 物质。
![]() (2)实验三中,洗气装置内的洗涤液一般用 溶液。
(2)实验三中,洗气装置内的洗涤液一般用 溶液。
![]() (3)在反应物的量相同情况下,该学生尝试用集气装置A和集气装置B分别和洗气装置相连来收集气体。选用集气装置 (选填“A”或“B”)可收集到更多的气体。经试验,该学生最终选用集气装置B进行下一步实验。其选择装置B的原因是
(3)在反应物的量相同情况下,该学生尝试用集气装置A和集气装置B分别和洗气装置相连来收集气体。选用集气装置 (选填“A”或“B”)可收集到更多的气体。经试验,该学生最终选用集气装置B进行下一步实验。其选择装置B的原因是
![]() 。
。
![]() (4)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为 。
(4)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为 。
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h
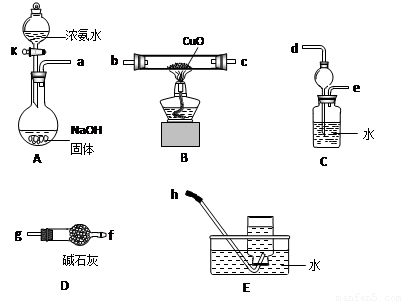
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
活性炭吸附法是工业提碘的主要方法之一。其流程如下:
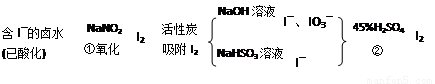
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3–
+ H2O H2SO3 + OH– 和
②
(写出离子方程式)
H2SO3 + OH– 和
②
(写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com