
题目列表(包括答案和解析)


 随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:
随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:| 四氯化碳 |
| 四氯化碳 |
(18分)
|

 ;
;(18分) 某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
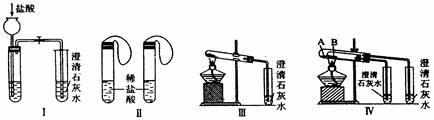
实验一、如图Ⅰ~Ⅳ所示。

(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 ,能说明碳酸钠比碳酸氢钠稳定的实验现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号) 。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据 ;若不能,请简要说明理由 。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(1)当石灰水过量时,反应的离子方程式为 。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 。
实验三、检验“侯氏制碱法”制得的纯碱中是否混有食盐和小苏打。
(1)检验纯碱中是否混有食盐的试剂是 ;
(2)证明纯碱中混有小苏打的实验方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com