
题目列表(包括答案和解析)
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
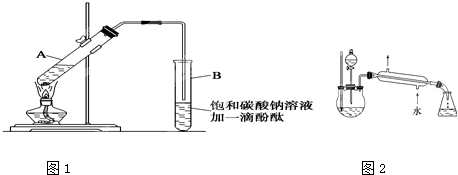
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化: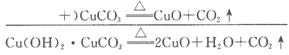
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
【化学——选修2化学与技术】
生产自来水的流程图所示。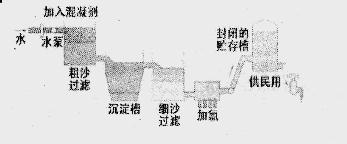
(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中, (填写序号)可以作为氯气的代用品。
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为 (以mg·L-l为单位)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com