
题目列表(包括答案和解析)
使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2
___________作指示剂。
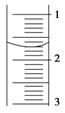
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
|
滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2
___________作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2_____作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。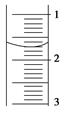
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
| |||||||||||||||||||||||||||||
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,
方法3:
⑴与方法3相比方法1的不足是 ,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是 。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是 。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用 洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b. 。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
|
滴定次数 |
盛标准Na2S2O3溶液的读数 |
|
|
滴定前刻度(/mL) |
滴定后刻度(/mL) |
|
|
1 |
1.02 |
11.03 |
|
2 |
2.00 |
11.99 |
|
3 |
0.20 |
10.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com