
题目列表(包括答案和解析)
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
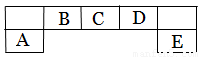
请用化学用语回答下列问题:
(1)D元素在周期表中的位置:???????????????
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 )
 (3)F与D同主族且相邻,其气态氢化物稳定性的大小??????? >???????? (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小??????? >???????? (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式????? ??????? ,该阳离子中存在的化学键有??????????????????? 。
 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因???????????????? .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因???????????????? .
(6)化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式????????????????????????????? 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是?????????? 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+?
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+?
c.m1 一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
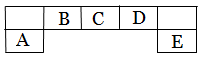
请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 ) (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
(16分) 短周期主族元素A、B、C、D、E、F 的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F的最高化合价为+7。试回答以下问题:
![]() (1)写出A与D以 1:1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
(1)写出A与D以 1:1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
![]() (2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
![]() (3)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(3)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
![]() ①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+); ![]() (填“>”、“<”、或“=”)
(填“>”、“<”、或“=”)
![]() ②求出混合溶液中下列算式的精确计算结果(填具体数字):
②求出混合溶液中下列算式的精确计算结果(填具体数字): ![]() c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
![]() (4)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“无法确定”)
(4)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“无法确定”)
(5)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的Ph≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
| ||
| ||
有短周期A、B、C、D、E五种元素,它们的原子序数由A至E渐大。D的氢化物的分子式为H2D,D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层上有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1mol的B单质与1.204×1023个H2完全反应。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试回答下列各问题。
(1)A~E的元素符号分别为______、______、______、______、______。
(2)C单质和B单质在加热条件下生成化合物A2B2,写出反应的化学方程式:
_______________________________________;
写出A2B2与A的氧化物反应的化学方程式:
_______________________________________。
(3)试写出D、E最高价氧化物水化物分子式_________,_________,并比较酸性强弱________________;写出D、E气态氢化物分子式___________、___________,比较它们的稳定性________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com