
题目列表(包括答案和解析)
装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R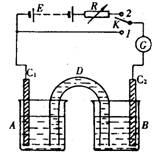 是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
已知AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
①两次操作过程中指针偏转的原因是
②指针偏转方向相反的原因是
③加盐酸时C1上发生的反应是
④加NaOH溶液时C1上发生的反应是
(10分)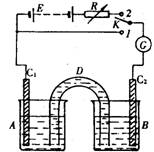 装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
1.已知AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
(1)两次操作过程中指针偏转的原因是
(2)指针偏转方向相反的原因是
(3)加盐酸时C1上发生的反应是
(4)加NaOH溶液时C1上发生的反应是
2.当 A中盛适量的1mol/L Na2SO4溶液,B中盛40mL适量浓度的KI-KHCO3溶液,且K接2时,可用该装置来测定砷的含量。其操作如下:称取5.00g含砷样品,溶解后加入还原剂,使砷全部转化为HAsO32-,除去过量的还原剂后再转移到250mL容量瓶中配成250mL溶液,用移液管从中取出10mL加入B中,边搅拌边电解,电解生成的 I2可将HAsO32-快速、定量地氧化为HAsO42-,以2mA的电流电解241s便可使反应进行完全。
(1)反应到达终点时宜用 来指示;
(2)假设电能没有损失,试求样品中As2O5的质量分数。
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | a | 945 |
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
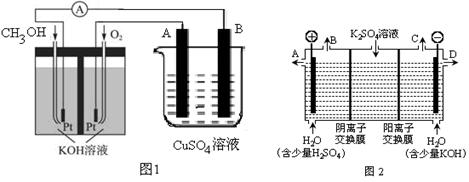
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池正极的电极反应式 。②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。

(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。
 K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com