
题目列表(包括答案和解析)
(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
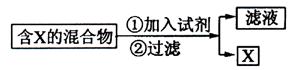
![]() (1)
(1)
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
![]() (2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中![]() 逐渐下降,
逐渐下降,![]() 、
、![]() 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的![]() 、
、![]() 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
|
|
|
|
| 溶度积 |
|
|
|
|
甲同学设计了如下除杂方案:
![]()
①试剂a是__________,其目的是____________________________________;根据溶度积该方案能够除去的杂质金属阳离子是____________。写出检验该杂质金属阳离子的操作方法:____________________________________________________________________________.
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使![]() 生成
生成![]() 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是________________________________________________________________________。
(14分)(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
(1)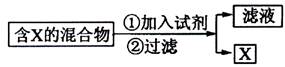
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中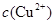 逐渐下降,
逐渐下降,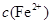 、
、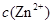 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的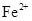 、
、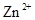 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |  | 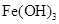 |  |  |
溶度积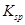 | 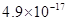 | 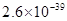 | 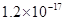 | 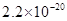 |
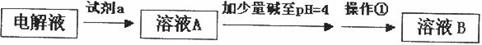
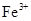 生成
生成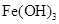 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
(1)
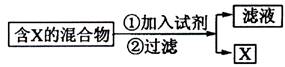
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中![]() 逐渐下降,
逐渐下降,![]() 、
、![]() 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的![]() 、
、![]() 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
|
|
|
|
| 溶度积 |
|
|
|
|
甲同学设计了如下除杂方案:
![]()
①试剂a是__________,其目的是____________________________________;根据溶度积该方案能够除去的杂质金属阳离子是____________。写出检验该杂质金属阳离子的操作方法:____________________________________________________________________________.
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使![]() 生成
生成![]() 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com