24.解:(1)对小物块,由A到B有
 …………1分
…………1分
在B点 …………2分
…………2分
所以 …………1分
…………1分
(2)对小物块,由B到O有
 …………2分
…………2分
其中 …………1分
…………1分
在O点 …………1分
…………1分
所以N=43N
由牛顿第三定律知对轨道的压力为 …………1分
…………1分
(3)物块沿斜面上滑: …………1分
…………1分
所以
物块沿斜面上滑: …………1分
…………1分
由机械能守恒知
小物块由C上升到最高点历时 …………1分
…………1分
小物块由最高点回到D点历时 …………1分
…………1分
故 …………1分
…………1分
即 …………1分
…………1分
(4)小物块在传送带上加速过程: …………1分
…………1分
PA间的距离是 …………1分
…………1分
25.解:(1)当金属棒匀速下滑时速度最大,设最大速度为vm,
达到最大时则有  …………2分
…………2分


所以 …………2分
…………2分
解得最大速度 …………1分
…………1分
(2)整个电路消耗的电功率 …………2分
…………2分
所以P=100W …………1分
(3)金属棒下滑稳定时,两板间电压U=IR2=15V
因为液滴在两板间有 …………2分
…………2分
所以该液滴在两平行金属板间做匀速圆周运动,
当液滴恰从上板左端边缘射出时:
所以 …………2分
…………2分
当液滴恰从上板右侧边缘射出时:
所以 …………2分
…………2分
初速度v应满足的条件是: 或
或
…………1分
26.(16分)
(1)太阳光能(1分) 生产者(水稻和杂草)(1分)营腐生活的细菌和真菌(蘑菇)
(2)标志重捕法 样方法(2分)
(3)抵抗力(2分) 生物种类少、营养结构简单(2分)
(4)氮素不断通过产品输出该生态系统(2分)
 (5)(2分)
(5)(2分)
27.(17分)
(1)一 (1分)(2)E或e(2分) 基因的分离(2分)
(3)50%(2分) 100%(2分)
(4)实验步骤:腿部无斑纹(2分)
腿部有斑纹(2分)
结果分析:腿部有斑纹(2分)
腿部无斑纹(2分)
28.(11分)(1)NO2、SO2(1分);0.3(2分);3(2a+b)/80(2分)
 (2)SO2+Ca(OH)2
CaSO3↓+H2O(1分);
(2)SO2+Ca(OH)2
CaSO3↓+H2O(1分);
 2CaSO3+O2+4H2O 2CaSO4?2H2O(1分)
2CaSO3+O2+4H2O 2CaSO4?2H2O(1分)
(3)①释放(2分)②32(mol?L―1)―1(2分)
 29.(15分)(1)A(2分)2Fe2++H2O2+2H+
2Fe3++2H2O(2分)
29.(15分)(1)A(2分)2Fe2++H2O2+2H+
2Fe3++2H2O(2分)
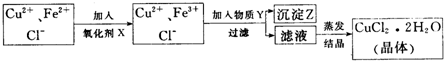
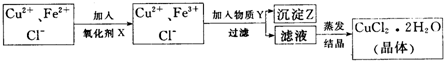
(2)CuO或Cu(OH)2或CuCO2(2分);调节溶液的pH,只生成Fe(OH)3沉淀(2分);

(3)电解
(2分)
(3分) (4)加入适量稀盐酸(2分) 30.(16分)(1)a;b接f;g接c(或b;a接f;g接c)(2分) (2)②⑤④①③(2分) (3)检验CO2是否除净(2分);证明有新的CO2生成,并说明乙二酸分解产物中有CO (2分) (4)属气处理,防止CO污染环境(2分) (5)3:8(3分) (6)有(1分);挥发出来的草酸和Ba(OH)2反应会干扰CO2的检验(2分。其它合理答案酌情给分) 【选做部分】 31.(8分)【化学―化学与技术】 (1)硫酸铵(或硫酸钾或过磷酸钙等)(1分) (2)CD(1分) (3)99.75%(2分) (4)SO3
从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流。(2分)   SO2+NH3+H2O NH4HSO3;2NH4HSO3+H2SO4 (NH4)3SO4+2H2O+2SO2↑ SO2+NH3+H2O NH4HSO3;2NH4HSO3+H2SO4 (NH4)3SO4+2H2O+2SO2↑
  (或SO2+2NH3+H2O (NH4)2SO3;(NH4)2SO3+H2SO4 (NH4)2SO4+H2O+SO2↑)
(或SO2+2NH3+H2O (NH4)2SO3;(NH4)2SO3+H2SO4 (NH4)2SO4+H2O+SO2↑)
(2分) 32.(8分)【化学物质结构与性质】 (1)1s22s22p63s23p4(2分)  (2)H―N―H(1分) sp3(1分)
(2)H―N―H(1分) sp3(1分)
H (3)C3N4(或B3C4)(1分) (4)离子晶体(1分)6(2分) 33.(8分)【化学―有机化学基础】 (1)B(1分)
|
|

(2) (3)醛基;羧基(各1分)

(5) CHO?2Cu(OH)2
COOH+Cu2O+2H2O(2分) 氢化反应(每空1分,共8分) 34.(1)B (2)灭菌 检验培养基(过程)是否被污染 (3)葡萄(果)酒 (4)带电性质 分子大小 (5)共价键结合法 可以重复使用(产品易纯化) 35.(1)基因工程、植物组织培养 植物体细胞杂交(细胞融合) (2)脱分化、再分化 (3)质粒 将目的基因导入受体细胞 (4)打破生殖隔离、实现遗传物质的定向改变、克服了远缘杂交不亲和的障碍、周期短 (5)ABCD 36.(8分) (1)对于A、B、C三个状态,由玻意耳定意可知:  ……………3分 ……………3分

即:在温度保持T0的情况下,气体体积在 之间变化。……………2分 之间变化。……………2分 (2)在气体状态由B变化至C的过程中,由于温度不变,所以气体内能不变,而该过程气体体积减小,外界对气体做功,所以由热力学第一定律可知,此过程是放热的。……………3分 37.(8分)由折射定律可知: ……………2分 ……………2分 其中,  ……………2分 ……………2分
所以, ……………2分 ……………2分 38.(8分) 由 可知,A球碰后的速度 可知,A球碰后的速度 ……………2分 ……………2分 由于A、B碰撞过程中动量守恒,所以 
解得:当 ……………2分 ……………2分 由于第一组答案不符合实际运动情况,应舍去,所以碰后B球的速度为 ………2分 ………2分
| | | | | |