
题目列表(包括答案和解析)
(8分)已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
 甲、乙两个实验小组欲探究影响化学反应速率的因素,设计
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计
实验方案如下(实验中所用KMnO4溶液均已酸化):
(1)甲组:通过测定单位时间内生成CO2气体体积的量来比
较化学反应速率,实验装置如图,实验时分液漏斗中A溶
液一次性加入,A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1H2C2O4溶液 | 4mL 0.01 mol·L-1KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 少量MnSO4(催化剂) |
该实验探究的是 因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1 KMnO4溶液。将四支试管分成两组(每组各有一支盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是 。
(12分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1) 已知草酸(H2C2O4)晶体分解的化学方程式为
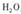 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。

(2) 某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3• nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A中盛放的液态试剂是________ (填编号)。
a.浓硫酸 b.饱和碳酸氢钠溶液 c.氢氧化钠溶液 d.氯化钙溶液
②在点燃C处酒楮灯之前应进行的操作是:(a)检查装置气密性;(b) ________________
③某同学认为铁锈样品与硝酸反应产物中除 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。
a. KSCN溶液和氯水 b.铁粉和KSCN溶液 C.浓氨水 d.酸性KMnO4溶液
④在本实验中,下列情况会使测定结果n偏大的是________ ________ (填编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3 • nH2O
⑤准确称量样品的质量10. 00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n =________。
(12分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1) 已知草酸(H2C2O4)晶体分解的化学方程式为。下列装置中,可用作上述反应制取气体的是(填编号)。
(2) 某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3• nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气体,洗气瓶A中盛放的液态试剂是________ (填编号)。
a.浓硫酸 b.饱和碳酸氢钠溶液 c.氢氧化钠溶液 d.氯化钙溶液
②在点燃C处酒楮灯之前应进行的操作是:(a)检查装置气密性;(b) ________________
③某同学认为铁锈样品与硝酸反应产物中除外还可能含有
。若要确认其中的
.应选用 ________________(填编号)。
a. KSCN溶液和氯水 b.铁粉和KSCN溶液 C.浓氨水 d.酸性KMnO4溶液
④在本实验中,下列情况会使测定结果n偏大的是________ ________ (填编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3• nH2O
⑤准确称量样品的质量10. 00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n =________。
(12分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1) 已知草酸(H2C2O4)晶体分解的化学方程式为
 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。
(2) 某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3? nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气体,洗气瓶A中盛放的液态试剂是________ (填编号)。
a.浓硫酸 b.饱和碳酸氢钠溶液 c.氢氧化钠溶液 d.氯化钙溶液
②在点燃C处酒楮灯之前应进行的操作是:(a)检查装置气密性;(b) ________________
③某同学认为铁锈样品与硝酸反应产物中除 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。
a. KSCN溶液和氯水 b.铁粉和KSCN溶液 C.浓氨水 d.酸性KMnO4溶液
④在本实验中,下列情况会使测定结果n偏大的是________ ________ (填编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3? nH2O
⑤准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n =________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com