
题目列表(包括答案和解析)
(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ―Ⅳ所示。
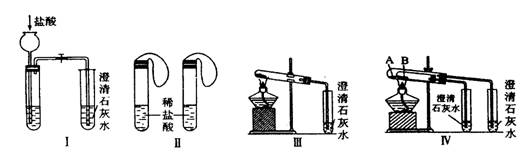
(1) 只根据图I、II所示实验,能够更好的达到实验目的是(填装置序号)__________;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为_____ ;与实验III相比,实验IV的优点是(填选项序号)_______________;
A.IV比III复杂
B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为_________,请设计实验检验所得溶液中溶质的阴离子 。
某学校课外探究小组想利用过氧化钠以及如图所示装置制取氧气并进行相关的实验探究.
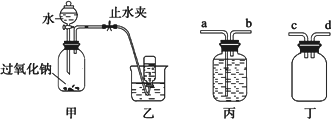
取适量Na2O2粉末放入广口瓶中,在分液漏斗中加入水,逐滴滴入到广口瓶中.用排水法收集气体.
(1)写出装置甲中发生反应的化学方程式:________.
(2)写出检查装置甲气密性的方法:________.
(3)收集气体时,可能会出现倒吸现象,为了防止大量的水进入装置甲中,可以在甲、乙装置之间增加一个装置,该装置为________(从“丙、丁”装置中选取),________(从“a、b、c、d”中选取)连接装置甲的出气口.
(4)为了收集纯净的氧气,应该对题目给出的装置进行改进,请你叙述这种改进措施:________.
(5)某同学取上述实验得到的广口瓶内的溶液滴加在试管中,然后再滴入2~3滴酚酞试液,溶液变红,但振荡试管,红色迅速褪去.
该同学通过查阅资料得知下列两个信息:
资料1:酚酞在c(OH-)为1.0×10-4~2.5 mol·L-1时呈红色,且0.5 min内不会褪色.
资料2:H2O2具有氧化性和漂白性.
因此该同学认为“红色迅速褪去”是因为溶液中存在H2O2.试设计实验证明广口瓶内的溶液中含有H2O2,简述实验操作:________;
设计实验证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”:________.


校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量。下面是测定实验分析报告。(请填写有关空白)
1.测定目的:测定××牌软包装橙汁维生素C含量。
2.测定原理:C6H8O6+I2→C6H6O6+2H++2I-
3.实验用品及试剂:(1)仪器和用品:(自选,略)
(2)试剂:指示剂________(填名称)、浓度为7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
4.实验过程:(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
5.数据记录与处理:(请在下面空白处设计数据记录和数据处理的表格,不必填数据)________。
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
6.问题讨论:(1)滴定时能否剧烈摇动锥形瓶?为什么?
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?__________(A.是加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂。)你是否同意这种做法?________
(A.同意 B.不同意 C.调查后再作结论)
维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧所氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg×L-1左右。
校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量。下面是测定实验分析报告。(请填写有关空白)
1.测定目的:测定××牌软包装橙汁维生素C含量。
2.测定原理:C6H8O6+I2→C6H6O6+2H++2I-
3.实验用品及试剂:(1)仪器和用品:(自选,略)
(2)试剂:指示剂________(填名称)、浓度为7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
4.实验过程:(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
5.数据记录与处理:(请在下面空白处设计数据记录和数据处理的表格,不必填数据)________。
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
6.问题讨论:(1)滴定时能否剧烈摇动锥形瓶?为什么?
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?__________(A.是加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂。)你是否同意这种做法?________
(A.同意 B.不同意 C.调查后再作结论)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com