
题目列表(包括答案和解析)
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二
实验三 实验四
结果:
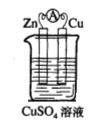
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率): 。
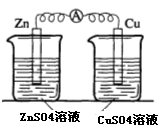
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
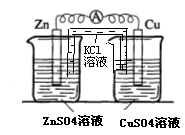
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
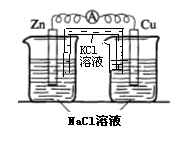
(4)实验四中电流计指针有偏转,写出铜极的电极反应式: ![]()
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。

(3)海绵钛可用碘提纯,原理为: ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
(9分)(1)电动汽车的动力系统由“10kW电机+144V镍氢电池”组成。
镍氢电池的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2=== NiO(OH)+1/2H2。其放电时正极电极反应式为_________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
①单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com