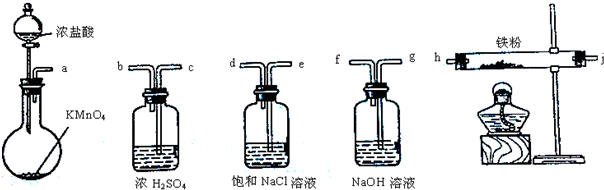
I.化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸的反应生成FeCl
2还是FeCl
3”.请你参与探究并回答有关问题:
(1)一位同学向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe
2+.
①可观察到实验现象是
产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀
产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀
,
②反应过程中发生反应的化学方程式是
FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3
FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3
.
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现血红色,但当滴加过量新制氯水时,却发现红色褪去.为了弄清溶液红色褪去的原因,同学们查到如下资料:
①铁有一种化合物称为铁酸盐(含有FeO
42-).
②SCN
-的电子式为

.
③氯水具有很强的氧化性.
于是同学们提出两种假设,
①第一种假设是:Cl
2可将Fe
3+氧化为FeO
42-,请写出该离子反应方程式
2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+
2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+
.
②第二种假设是:
SCN-被Cl2氧化
SCN-被Cl2氧化
,
II.某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染.请填写下列空白:
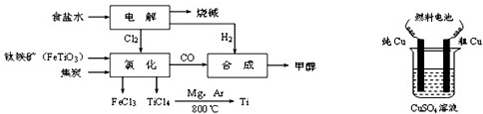
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
.
(2)由CO和H
2合成甲醇的方程式是:CO(g)+2H
2(g)?CH
3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H
2和2mol CH
3OH充入容积为2L的密闭容器中,此时反应将
向逆反应方向进行
向逆反应方向进行
(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2t甲醇,至少需额外补充H
21.0
1.0
t.
(3)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜,在接通电路一段时间后纯Cu质量增加3.2g.
①请写出燃料电池中的负极反应式:
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.
②燃料电池正极消耗空气的体积是
2.8L
2.8L
(标况,空气中O
2体积分数以20%计算).

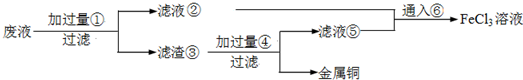
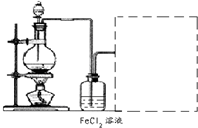
 .
.