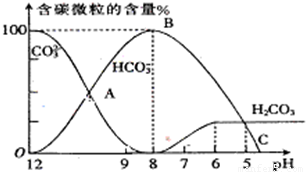
I.常温下在20mL0.1mol?L
-1Na
2CO
3溶液中逐滴加入0.1mol?L
-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO
2因逸出未画出),如图所示.回答下列问题:
(1)H
2CO
3、HCO
3-、CO
32-中不能大量共存于同一溶液中的是______.
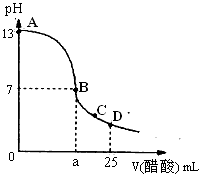
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点…
指示剂B的变色范围在pH=______左右最理想.
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是______.
(4)已知在25℃时,CO
32-水解反应的平衡常数即水解常数K
h=
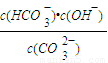
=2×10
-4,当溶液中c(HCO
3-):c(CO
32-)=2:1时,溶液的pH=______.
II.某二元弱酸(简写为H
2A)溶液,按下式发生一级和二级电离:H
2A

H
++HA
- HA
-
H
++A
2-已知相同浓度时的电离度α(H
2A)>α(HA
-),设有下列四种溶液:
(A)0.01mol.L
-1的H
2A溶液
(B)0.01mol.L
-1的NaHA溶液
(C)0.02mol.L
-1的HCl与0.04mol.L
-1的NaHA溶液等体积混合液
(D)0.02mol.L
-1的NaOH与0.02mol.L
-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(5)c(H
+)最大的是______,c(H
2A)最大的是______,c(A
2-)最大的是______.


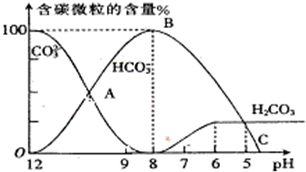 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2- I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: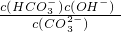 =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.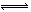 H++HA- HA-
H++HA- HA- H++A2-
H++A2-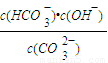 =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______. H++HA- HA-
H++HA- HA- H++A2-
H++A2-