
题目列表(包括答案和解析)
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。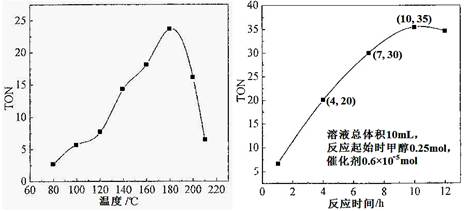
(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
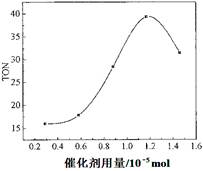
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH-、H+四种微粒浓度由大到小关系为: 。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.

将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO ![]() CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡 所需时间 | ||
H2O | CO | H2 | CO | |||
l | 650℃ | lmol | 2mol | 0.6mol | 1.4mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为![]() 、Ka2,且
、Ka2,且![]() ≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com