
题目列表(包括答案和解析)
请回答下列问题:?
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·aH2O)对制取硫酸亚铁有无影响 (填“有”或“无”)。其原因是: 。如有影响将如何操作? (若无影响,此问可以不答)。
(2)FeSO4在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于废铁屑含有C、Si等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,该小组实验时采取了水浴加热和趁热过滤的方法。这样做的主要目的是为了防止 。你认为实验时的水浴温度最好控制在 ℃?左右。??
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平(或物理天平)、研钵、坩埚、坩埚钳、三脚架、泥三角、酒精灯、药匙外,还有 ;判断晶体中结晶水完全失去的实验操作是 。?
(4)计算硫酸亚铁晶体化学式中x的实验值表达式为x= ?。(已知:硫酸亚铁晶体中结晶水的质量为m g、硫酸亚铁晶体的质量为w g)?
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有的同学提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应方程式为: 。?
请你再写出一种(不包括改变温度和硫酸的浓度)以铁单质为反应物,能加快制取FeSO4溶液反应速率的方法: 。?
药品:①2% NaOH溶液②稀HCl③稀H![]() SO
SO![]() ④饱和KHCO
④饱和KHCO![]() 溶液⑤浓H
溶液⑤浓H![]() SO
SO![]() ⑥CaCO
⑥CaCO![]() 固体⑦K
固体⑦K![]() CO
CO![]() 粉末
粉末
仪器装置(如图所示):
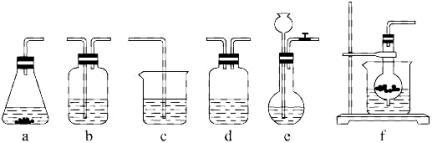
请根据题目要求完成下列问题:
请按下表要求,填写选择的装置和药品。
分项内容 | CO | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置 (填序号) |
|
| C |
选择的药品 (填序号) |
|
| ① |
(2)如何检验所选择的CO![]() 发生装置(X)的气密性,请写出主要操作过程:__________。
发生装置(X)的气密性,请写出主要操作过程:__________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为_____________,Y装置中除去的杂质为_________________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是______________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过________________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
化学式 | Na | NaHCO | NaOH | NaCl | Na |
溶解度 (g/100 g H | 21.3 | 9.60 | 107 | 35.8 | 19.4
|
某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
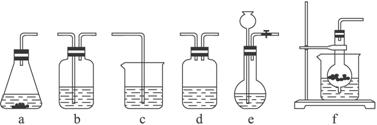
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品。
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:_________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________________,Y装置中除去的杂质为_____________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是____________________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_______________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100 g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO![]() 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液②稀HCl③稀H![]() SO
SO![]() ④饱和KHCO
④饱和KHCO![]() 溶液⑤浓H
溶液⑤浓H![]() SO
SO![]() ⑥CaCO
⑥CaCO![]() 固体⑦K
固体⑦K![]() CO
CO![]() 粉末
粉末
仪器装置(如图所示):
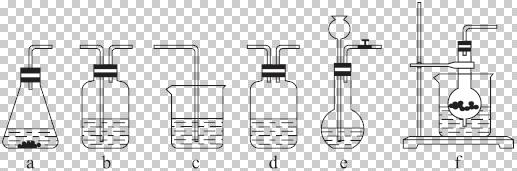
请根据题目要求完成下列问题:
请按下表要求,填写选择的装置和药品。
| 分项 内容 | CO (随开随用,随关随停) (X) | 除杂洗 气装置 (Y) | 制备产 品装置 (Z) |
| 选择的装置 (填序号) | C | ||
| 选择的药品 (填序号) | ① |
(2)如何检验所选择的CO![]() 发生装置(X)的气密性,请写出主要操作过程:__________。
发生装置(X)的气密性,请写出主要操作过程:__________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为_____________,Y装置中除去的杂质为_________________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是______________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过________________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
| 化学式 | Na | NaHCO | NaOH | NaCl | Na |
| 溶解度 (g/100 g H | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com