
题目列表(包括答案和解析)
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解CuCl2溶液,所用仪器如图:
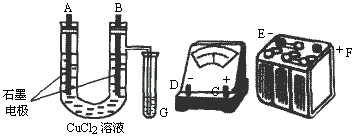
②在电流强度为I安培,通电时间为t秒钟后,精确测得某电极上析出的铜的质量为m g.试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示.下同)
E接________,C接________,________接F.
实验线路中的电流方向为________→________→________→C→________→________.
(2)写出B电极上发生反应的离子方程式________,G试管中淀粉KI溶液变化的现象为________,相应的离子方程式是________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库仑.试列出阿伏加德罗常数的计算表达式:NA=________.
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器下图所示:
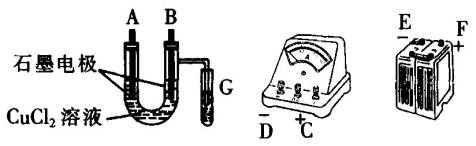
②在电流强度为IA,通电时间为t s后,精确测得电极上析出的铜的质量为m g.试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器连接线柱的英文字母表示.下同)E接____________,C接____________,____________接F.
实验线路中的电流方向为________→________→________→C________→________.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为________,相应的离子方程式是________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是___________
________.(选填下列操作步骤的编号)
①称量电解前电极质量;
②刮下电解后电极上的铜并清洗;
③用蒸馏水清洗电解后电极;
④低温烘干电极后称量;
⑤低温烘干刮下的铜后称量;
⑥再次低温烘干后称量至恒重.
(4)已知电子的电量为1.6×10-19C.试列出阿伏加德罗常数的计算表达式:NA=________.
①用直流电电解氯化铜溶液,所用仪器下图所示:
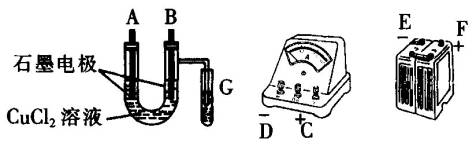
②在电流强度为IA,通电时间为t s后,精确测得电极上析出的铜的质量为m g.试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器连接线柱的英文字母表示.下同)E接____________,C接____________,____________接F.
实验线路中的电流方向为________→________→________→C________→________.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为________,相应的离子方程式是________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是___________
________.(选填下列操作步骤的编号)
①称量电解前电极质量;
②刮下电解后电极上的铜并清洗;
③用蒸馏水清洗电解后电极;
④低温烘干电极后称量;
⑤低温烘干刮下的铜后称量;
⑥再次低温烘干后称量至恒重.
(4)已知电子的电量为1.6×10-19C.试列出阿伏加德罗常数的计算表达式:NA=________.
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。

你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:

①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】
(08淄博市模拟)(18分)某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中

② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙该同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐
滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘
制其pH变化曲线(如图)。请回答:
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com