
题目列表(包括答案和解析)

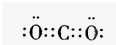
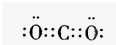
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。① ② ③ 。
(09盐城第三次调研)一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜。铁在不同浓度的硝酸中溶解与钝化情况如图如示。试探究下列问题:
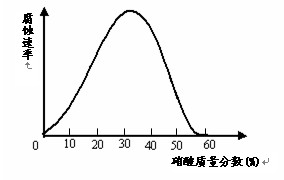
(1)现有一枚光亮的铁钉,欲使其表面形成钝化层,应将其放入浓度大于 的硝酸中一段时间;证明其表面已形成一层致密的钝化层的简单实验是: 。
(2)下列有关说法不正确的是 (选填序号)。
![]()
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定总是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:3Fe+NaNO2+5NaOH![]() 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O![]() 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: 。
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: 。
钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”.
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志.我国至今产量不足,尚需进口二氧化钛.“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O(硫酸钛酰)
②加水分解硫酸氧钛:TiOSO4+(n+1)H2O===TiO2·nH2O+H2SO4
③
煅烧TiO2·nH2O“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
①________;
②________.
根据废液主要成分,针对其中一项污染,提出处理的方法.③________
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究.
提出假设:a.Ti金属活动性比Mg强;b.Ti金属活动性比Cu弱.
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象.
①稀盐酸:放出H2速率Mg>Ti,铜不反应.②稀HF:放出H2速率Ti>Mg
根据上述________现象(填①或②)得出金属活动性Mg________Ti.如何解释另一反常现象________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com