
题目列表(包括答案和解析)

| ||
| ||
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
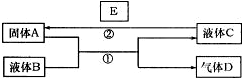 (2007?淄博三模)中学化学中有很多物质可以实现下图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.
(2007?淄博三模)中学化学中有很多物质可以实现下图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.
| ||
| ||
| Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com