
题目列表(包括答案和解析)
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白。要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是 :
a.干燥的氯气能否使试纸变白 b.水能否使试纸变白 c.盐酸能否使试纸变白
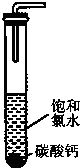
(2)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。如图所示在试管中加入过量的块状碳酸钙.再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去:过滤,将滤 液滴在蓝色石蕊试纸上发现其漂白性比饱和氯水的更强:已知饱和氨水中存在Cl2+H2O H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。

(3)碳酸钙与氯水反应生成的含钙的化合物除氯化钙外,有人提出如下猜想
a.含次氯酸钙 b.含碳酸氢钙 c.含次氯酸钙和碳酸氢钙。
有人认为不可能含有次氯酸钙.他的理由可能是 。
为了证明碳酸氢钙的存在,将滤液分为三份.分别进行以下实验:
①第一份与澄清石灰水混合,立即产生大量白色沉淀:此实验____(填“能”或“不能”)确证溶液中含有碳酸氢钙因为 ;
②第二份与稀盐酸混合,立即产生大量无色气体:
③将第三份加热,看到溶液变浑浊且有大量无色气体产生。反应的化学方程式为
④除上述实验外,你能设计的确证碳酸氢钙存在的实验方案是____。
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白。要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是 :
a.干燥的氯气能否使试纸变白 b.水能否使试纸变白 c.盐酸能否使试纸变白
(2)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。如图所示在试管中加入过量的块状碳酸钙.再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去:过滤,将滤 液滴在蓝色石蕊试纸上发现其漂白性比饱和氯水的更强:已知饱和氨水中存在Cl2+H2O H++C1-+HClO.反应后所得的溶液漂白性增强的原因是 (用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是 (用化学平衡移动原理解释)。
(3)碳酸钙与氯水反应生成的含钙的化合物除氯化钙外,有人提出如下猜想
a.含次氯酸钙 b.含碳酸氢钙 c.含次氯酸钙和碳酸氢钙。
有人认为不可能含有次氯酸钙.他的理由可能是 。
为了证明碳酸氢钙的存在,将滤液分为三份.分别进行以下实验:
①第一份与澄清石灰水混合,立即产生大量白色沉淀:此实验____(填“能”或“不能”)确证溶液中含有碳酸氢钙因为 ;
②第二份与稀盐酸混合,立即产生大量无色气体:
③将第三份加热,看到溶液变浑浊且有大量无色气体产生。反应的化学方程式为
④除上述实验外,你能设计的确证碳酸氢钙存在的实验方案是____。
 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
 (1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com