【实验名称】对草酸溶液中逐滴加入高锰酸钾溶液反应的速率变化的探究.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:(已知:
①MnO
4-在酸性环境下的还原产物是Mn
2+ ②2KClO
32KCl+3O
2↑,2KMnO
4K
2MnO
4+MnO
2+O
2↑)
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
试剂:草酸晶体( H
2C
2O
4?2H
2O、0.01mol/L KMnO
4溶液、稀硫酸、MnSO
4固体
【实验内容】
(1)0.10mol/L H
2C
2O
4溶液的配制:
实验室欲配制100mL 0.10mol/L H
2C
2O
4溶液,需要称取草酸晶体
1.3
1.3
g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和
100mL容量瓶
100mL容量瓶
.
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H
2C
2O
4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L
KMnO
4溶液和几滴稀硫酸.现做如下对比实验,现象如下表所示:
| 加入药品 |
不加MnSO4的硫酸
酸化的H2C2O4溶液 |
加少量MnSO4的硫酸
酸化的H2C2O4溶液 |
实验现象
(褪色时间)/s |
H2C2O4褪色很慢
(31秒) |
H2C2O4褪色很快(4秒) |
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是:
秒表
秒表
.
②H
2C
2O
4溶液与酸性的KMnO
4溶液反应的离子方程式为:
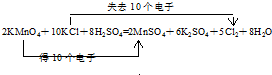
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
.
③甲同学测出的褪色时间是以下列哪个选项为依据的
C
C
.
A、从KMnO
4溶液滴加到刚好接触H
2C
2O
4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO
4溶液滴加到刚好接触H
2C
2O
4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO
4溶液滴加到刚好接触H
2C
2O
4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是
锰离子在反应中起到催化剂的作用,加快了反应速率
锰离子在反应中起到催化剂的作用,加快了反应速率
.于是甲同学得出结论
在其它条件不变的情况下,加入催化剂可加快化学反应速率
在其它条件不变的情况下,加入催化剂可加快化学反应速率
.
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I
该反应是放热反应,温度升高,反应速率增大,溶液褪色加快
该反应是放热反应,温度升高,反应速率增大,溶液褪色加快
,II
硫酸的浓度影响反应速率,加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应
硫酸的浓度影响反应速率,加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应
.