
题目列表(包括答案和解析)

| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |


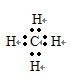
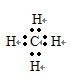
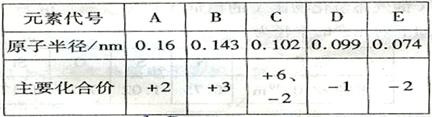
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为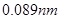 )
)
(1)B与D形成的化合物是 ;A和E形成的化合物是 。(填离子化合物或共价化合物)
(2)C的氢化物的电子式为 。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为: ;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式);
(5)C、E形成的化合物为 、 (填化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com