
题目列表(包括答案和解析)
①指出在使用下列仪器(已净)或用品的第一步操作:
②下面是中学化学实验常见的几种定量仪器:
A.量筒
B.容量瓶
C.滴定管
D.托盘天平,其中
(填代号)
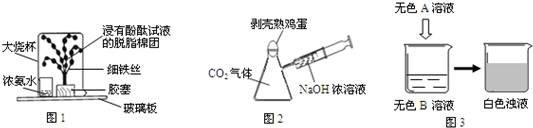
③利用图所示装置收集以下8种气体.(图中烧瓶的位置不得变化)

①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(答案均填序号)
(1)若烧瓶是干燥的,则由B口进气可收集的气体有________
(2)若烧瓶是干燥的,则由A口进气可收集的气体有________
(3)若烧瓶充满水,可收集的气体有________;此时气体由________口进入.
(4)若烧瓶内装入浓H2SO4进行气体干燥,则可用此装置干燥的气体有________,这时气体由________口进入.
(1)酸性:H2CO3__________H2SiO3,H2SiO3__________H3PO4
(2)碱性:Ca(OH)2__________Mg(OH)2,Mg(OH)2__________Al(OH)3
(3)气态氢化物稳定性:H2O__________H2S,H2S__________HCl
(4)还原性:H2O________H2S,H2S________HCl
(5)酸性:H2SO4__________H2SO3,HClO4__________HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越____________________;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越______________________;
③元素的__________性越强,其对应气态氢化物的稳定性越______________________;
④非金属性越强的元素生成的气态氢化物,其还原性越__________________________;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越______________.
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol·L-1的氨水,其pH为11.①.甲用蒸馏水稀释100倍后,溶液的pH将为a;②.乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol .则a、b正确的答案组合是 ( )
A.9~11之间; 0.1 B.9~11之间; 0.2 C.12~13之间; 0.2 D.13; 0.1
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com