黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS
2,现有一种天然黄铜矿(含少量脉石SiO
2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
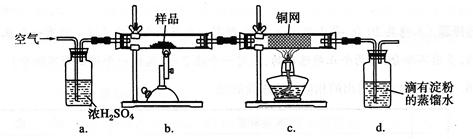
现称取研细的黄铜矿样品1.15Og,在空气存在下进行煅烧,生成Cu、Fe
2O
3、FeO和SO
2气体,实验后取d中溶液的
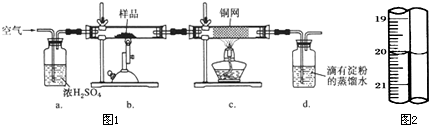
置于锥形瓶中,用0.O5mo1/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图2所示.
(1)冶炼铜的反应为8CuFeS
2+21O
28Cu+4FeO+2Fe
2O
3+16SO
2若CuFeS
2中Fe的化合价为+2,反应中被还原的元素是
(填元素符号);称量样品所用的仪器为
.
(2)装置a的作用是
.
A.有利于空气中氧气充分反应 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
.
(4)滴定时,标准碘溶液所耗体积为
mL.用化学方程式表示滴定的原理:
.
(5)通过计算可知,该黄铜矿的纯度为
.
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe
2O
3、FeO、SiO
2、AI
2O
3)可制备Fe
2O
3.选用提供的试剂,设计实验验证炉渣中含有FeO.提供的试剂:稀盐酸,稀硫酸,KSCN溶液,KMnO
4溶液,NaOH溶液,碘水,所选试剂为
.证明炉渣中含FeO有的实验现象为:
.