
题目列表(包括答案和解析)
(14分)在化学反应中,只要物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:2Na+C12 =2NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应(部分反应条件略去)属于氧化还原反应的是
(填写序号);
①C+O2 == CO2 ②CaO+H2O==Ca(OH)2 ③CaCO3==CaO+CO2↑
④2H2O2 == 2H2O+O2↑ ⑤CO+CuO=Cu+CO2 ⑥HCl+NaOH=NaCl+H2O
(2) 含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
①该反应的化学方程式可表示为 ;
②向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是
(写化学式,下同),滤液中的溶质是 。
(3) 通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中其元素化合价升高总数 (填“大于”、“等于”或“小于”)化合价降低升高总数。氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)
(4)柠檬果汁中含有维生素C(C6H8O6,简写成Vc)是还原剂,它能被I2氧化生成C6H6O6。当前市场上测定柠檬果汁中Vc含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol?dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol?dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
①Vc中碳元素的平均化合价是 。
②写出Vc与I2反应的离子方程式。
③此份果汁中含Vc= mg/100mL果汁。
 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
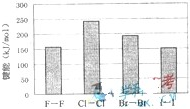
 卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).
卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).下图为周期表的一小部分,A、B、C、D、E、F的位置关系如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高价氧化物中含氧60%,回答下列问题:
F A
D B E
C
(1)A在周期表中的位置为 ;E的离子结构示意图为 ;化合物DE3的电子式_______。
(2)F元素氢化物的空间构型为_______。
(3)D、B、E元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 。(用化学式表示)
(4)B、C、E的气态氢化物稳定性由强到弱的顺序是________。(用化学式表示)
(5)B的单质与其最高价氧化物的水化物的浓溶液共热能发生反应,化学方程式为
。
(6)F2H4和FO2是一种双组分火箭推进剂。两种物质混合发生反应生成F2和H2O(g),已知8g F2H4气体在上述反应中放出142kJ热量,其热化学方程式为 。
(7)请在答题卷相应位置画出金属与非金属元素的分界线。
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
⑴在上述反应的反应物和生成物中,CO2的电子式 ,属于弱酸的电离方程式 。若0.1mol?L-1的该弱酸溶液的pH为a,则该弱酸的电离度为 (用a表示)
⑵反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是 (选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
⑶反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为 。
⑷Na2CO3俗称纯碱,属于 晶体。工业上制取纯碱的原料是 。
⑸F2能溶于NaOH溶液中生成OF2,写出该反应的化学方程式并配平
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com