
题目列表(包括答案和解析)
实验方案 | 实验现象 |
①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞试液 | A.浮于水面,溶成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的饱和Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,有气体产生 |
④镁带与稀盐酸反应 | D.剧烈反应,有气体产生 |
⑤铝条与稀盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:______________________________________________________。
(2)实验用品:仪器:①____________ ②____________ ③____________
④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片 ⑧砂纸 ⑨火柴
药品:钠、镁带、铝条、稀盐酸、新制氯水、饱和Na2S溶液、AICl3溶液、氢氧钠溶液、酚酞试液。
(3)实验内容:(填写与实验方案相对应的实验现象和有关化学反应的离子方程式
实验方案 | 实验现象(填写字母) | 离子方程式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
|
⑥ |
|
|
(4)实验结论:___________________________________________________________。
请从原子结构理论方面简单说明具有上述结论的原因_________________________。
(5)请你补充一个实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
_____________________________________________________________________。
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。
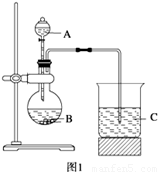
(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
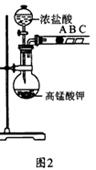
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。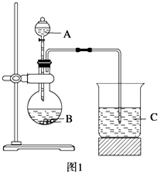
(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
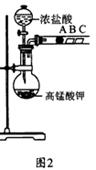
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。
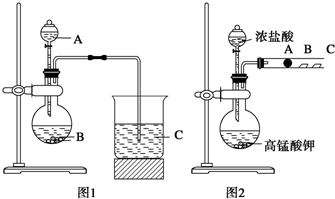 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.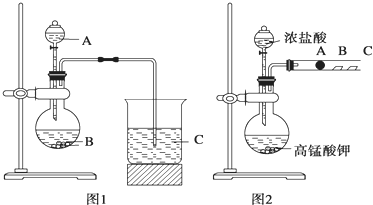
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com