
题目列表(包括答案和解析)
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,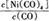 减小,则?H 0(填“>”或“<”)。
减小,则?H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol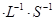 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: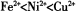 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。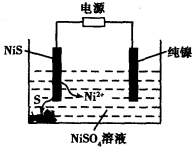
自然界中的硫
认识硫单质
(1)硫的物理性质
硫俗称________,它是一种________色或________色固体,很脆,易研成粉末,________溶于水,________溶于酒精,________溶于CS2;熔点和沸点________.
(2)硫的同素异形体
硫的同素异形体有多种,稳定存在的是斜方硫(S8)和单斜硫(S8).
(3)硫的化学性质
①硫与金属的反应
Fe+S![]()
![]() (Fe有+2、+3价)
(Fe有+2、+3价)
2Cu+S![]()
![]() (Cu有+1、+2价)
(Cu有+1、+2价)
Hg+S![]()
![]() (Hg有+1、+2价)
(Hg有+1、+2价)
②硫与非金属的反应
![]() +O2
+O2![]()
![]() (S是还原剂)
(S是还原剂)
H2+![]()
![]()
![]() (S是氧化剂)
(S是氧化剂)
C+![]()
![]()
![]() (S是氧化剂)
(S是氧化剂)
③黑火药爆炸
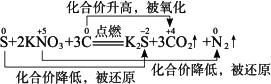
(4)硫的主要用途:制造硫酸、化肥、火柴、杀虫剂、火药、烟花爆竹、医药、硫化橡胶,硫还是酸性速效肥料,等等.
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com