
题目列表(包括答案和解析)
(1)下列说法不正确的是( )
A.硫是一种淡黄色的能溶于水的固体 B.硫在自然界中仅以化合态存在
C.硫跟铁反应生成硫化亚铁 D.硫在空气中的燃烧产物是二氧化硫
(2)下列关于二氧化硫的说法中,不正确的是( )
A.不能使澄清的石灰水变浑浊 B.无色,有刺激性气味,有毒
C.既有氧化性,又有还原性 D.既可溶于水,又可跟水反应
(3)下列物质间的反应中,硫表现出还原性的是( )
A.硫与氢气 B.硫与氧气
C.硫与铁 D.硫与钠
(4)在加热条件下:H2S![]() S+H2,硫元素在此反应中表现出( )
S+H2,硫元素在此反应中表现出( )
A.酸性 B.不稳定性 C.氧化性 D.还原性
(5)能够用于鉴别二氧化硫和二氧化碳的溶液是( )
A.澄清的石灰水 B.品红溶液
C.紫色石蕊溶液 D.氯化钡溶液
(6)形成酸雨的主要原因是( )
A.未经处理的工业废水任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫的燃料和含硫矿石的冶炼
D.汽车排放的尾气和燃料不完全燃烧产生的气体
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
|
资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
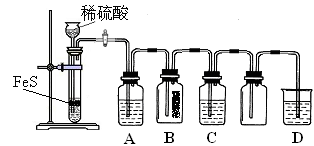
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。

回答下列问题:
① A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为_________________。
② B中的现象是_________。
③ C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为_____。
④ D中盛放的试剂可以是____________(填标号)。
a. 水 b. 盐酸 c. NaCl溶液 d. NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验。
|
|
实验操作 |
实验现象 |
|
实验1 |
将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 |
无明显现象 |
|
实验2 |
将H2S通入Na2SO3溶液中 |
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
|
实验3 |
将SO2通入Na2S溶液中 |
有浅黄色沉淀产生 |
已知:电离平衡常数:H2S Ka1 =1.3×10-7;Ka2 = 7.1×10-15
H2SO3 Ka1 =1.7×10-2;Ka2 = 5.6×10-8
① 根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(填序号)。




A B C D
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_______。
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
| 资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
 |  |  |  |
| A | B | C | D |
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08mg/m![]() 。可利用酸性高锰酸钾溶液测定甲醛含量。
。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4(H![]() )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
![]() 有关离子方程式为:
有关离子方程式为:
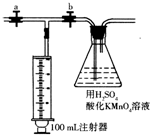
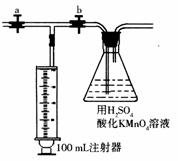 测定装置:部分装置如右图所示(a、b为止水夹)。
测定装置:部分装置如右图所示(a、b为止水夹)。
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②准确量取5.00 mL 1.00×10![]() mol/L的高锰酸
mol/L的高锰酸
钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L
的H2SO4溶液,加水45 mL稀释,备用。
③将1.00×10![]() mol/L的草酸标准溶液置于酸式滴定管中备用。
mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
回答以下问题:
(1)甲醛的结构式是__________。
(2)利用甲醛完成银镜反应,1 mol甲醛最多可以制__________mol银。
(3)使用_________量取5.00 mL高锰酸钾溶液。
(4)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低?
(5)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
(6)计算该居室内空气中甲醛的浓度_________mg/m![]() ,该居室的甲醛________.(填“是”或“否”)超标。
,该居室的甲醛________.(填“是”或“否”)超标。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com