
题目列表(包括答案和解析)
用50 mL NaOH溶液吸收CO2气体制备Na2CO3,为防止通入的CO2过量而生成NaHCO3?,他设计了如下步骤:①用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小心煮沸溶液1—2 min;③在得到的溶液中加入另一半(25 mL) NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?__________,理由是_____________________________。
(2)按他的设计,第①步实验装置如图15-7所示:
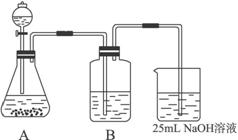
图15-7
a.装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?____________,原因是__________________________________________________________。
b.装置B使用的试剂是_____________,作用是_____________________________________。
c.为了后续的加热煮沸、混合等实验,盛NaOH溶液的容器还可使用__________(填实验仪器)。
d.有人认为将实验步骤②③的顺序对调,即先混合,再煮沸,这样操作更合理,你认为对吗?_________;为什么?___________________________________________________。
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为 而后又发生反应的离子方程式为
在(Ⅱ)中煮沸溶液的目的是
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是 。
(2)按该同学的设计,第(I)步实验装置如下:
①装置A使用的试剂是 (固体)和 ;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为 而后又发生反应的离子方程式为
在(Ⅱ)中煮沸溶液的目的是
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是 。
(2)按该同学的设计,第(I)步实验装置如下:
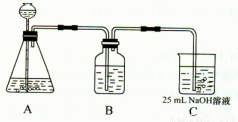
①装置A使用的试剂是 (固体)和 ;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(Ⅰ)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.
(1)在(Ⅰ)中,刚通人CO2时发生的反应化学方程式为________;而后又发生反应的离子方程式为________.
在(Ⅱ)中煮沸溶液的目的是________.
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是________.
(2)按该同学的设计,第(I)步实验装置如下:
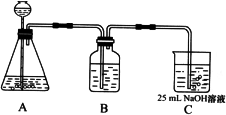
①装置A使用的试剂是________(固体)和________溶液;
②装置B使用的试剂最好是________(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是________,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有________.
硫酸亚铁铵是一种常用化学试剂,其晶体[(NH4)2Fe(SO4)2·6H2O]溶于水电离成简单离子,在乙醇中溶解度很小。
Ⅰ、硫酸亚铁铵晶体的制取
①用热的Na2CO3溶液洗涤除去铁屑表面油污;②用蒸馏水洗涤铁屑;③将铁屑溶于足量稀硫酸,过滤;④滤液中加入(NH4)2SO4固体,经溶解、蒸发结晶、过滤、洗涤、干燥得硫酸亚铁按晶体。
(1)用热的Na2CO3溶液除去油污的原理是 。
(2)铁屑因被空气氧化含少量Fe2O3,加稀H2SO4时Fe2O3会溶解产生少量Fe3+,但铁屑被H2SO4充分溶解后的溶液中并未检测出Fe3+,用离子方程式说明原因: 。
(3)步骤④中过滤得到的晶体表面含少量水,可用无水乙醇洗涤除去。需要用无水乙醇洗涤的理由是 。
Ⅱ.测定产品中各种离子含量
(4)称取ag产品,准确配制250mL溶液,取出25.00 mL溶液,加入足量BaCl2溶液,然后过滤、洗涤沉淀、烘干称重,得到bg沉淀。ag产品中含SO42—的物质的量为 mol。
(5)取(4)所配溶液25.00 mL放入锥形瓶,加入足量稀H2SO4,然后用0.1000mol·L—1,KMnO4溶 液滴定,终点时消耗20.00mL KMnO4溶液。滴定时反应的离子方程式(未配平)为: Fe2++ H++ MnO4—= Fe3++ Mn2++ H2O
①配平上述离子方程式,并标明电子转移的方向和总数。
②若上述数据只由一次滴定测得,某同学据此计算出ag产品中Fe2+含量为0.1mol。该同学得出结果的做法是否合理,请说明理由: 。
(6)另取ag产品,放入烧瓶中,加入足量NaOH溶液,产生气体用足量稀H2SO4吸收。实验前后稀H2SO4增重cg。实验装置如图。

结果表明按该方案测定NH4+的量时会产生较大误差,请对如 下两种情况的原因进行分析:
①NH4+测定结果偏高,原因可能 ;
②NH4+测定结果偏低,原因可能 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com