
题目列表(包括答案和解析)
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
工业制硫酸的关键步骤之一为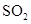 的接触氧化:
的接触氧化: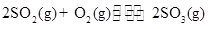 ;
;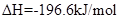 。现在一容积为2 L的密闭容器中充入2 mol
。现在一容积为2 L的密闭容器中充入2 mol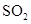 、1 mol
、1 mol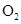 ,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是 ( )
,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是 ( )
A.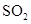 的转化率为30%
的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用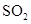 表示的5 min内的平均反应速率为0.36 mol·L
表示的5 min内的平均反应速率为0.36 mol·L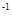 .min
.min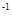
D.相同条件下,起始时若加入2 mol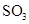 ,达到的平衡状态完全相同
,达到的平衡状态完全相同
工业制硫酸的关键步骤之一为SO2的接触氧化:
 2SO2(g)+O2(g) 2SO3(g);△H= —196.6kJ/mol
2SO2(g)+O2(g) 2SO3(g);△H= —196.6kJ/mol
现在一容积为2L的密闭容器中充入2 molSO2、l molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 mm时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是 ( )
A.S02的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应谏率为u.30 mol·L—1,min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态与上述平衡完全相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com