
题目列表(包括答案和解析)
微粒代码 | a | b | c | d | e | f | g | h |
原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:?
(1)a微粒原子核外结构示意图: ,c微粒电子式为 。?
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为: > (写化学式)?
(3)c微粒和f微粒反应生成2分子g的离子方程式为 。?
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为 。?
(5)大量微粒g所构成的晶体属 ;d微粒分子结构呈 ;h微粒所构成的晶体中化学键的类型有 。
(1)A、B、C、D、E各是(填写元素符号) _________________________________________。
(2)A、B、C、D、E在周期表中的位置依次是____________________________________。
(3)A、B、C、D、E中得电子能力最强的元素是_________________,失电子能力最强的元素是____________。
(4)现行元素周期表中得电子能力最强的元素是_________________,失电子能力最强的元素是______________。
(5)随着周期表的逐步完善,用发展的观点分析,元素周期表中得失电子能力最强的元素是否会发生变化?
__________________________________________
A.______________, ______________; B. ______________,______________;
C. ______________,______________; D. ______________,______________;
E. ______________,______________。
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
粒子代码 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数(单位:电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的原子结构示意图________________________________________.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为__________>__________(用化学式表示)。
(3)d溶于水的电离方程式__________________。
(4)g粒子所构成的晶体类型属__________________。
(5)c粒子是__________________,f粒子是__________________ (用化学式表示)。
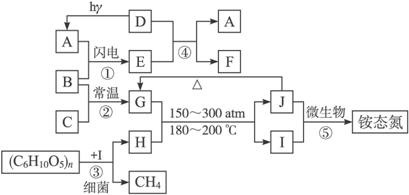
图4-1
请回答下列问题:
(1)C的名称是___________;反应①②共同的化学、生物学意义是什么?
(2)与反应④有关的环境公害是什么?分析其中D所起的作用。__________________________________________________________________
(3)与物质H有关的环境公害是什么?美国目前是世界上造成这种环境公害最严重的国家;你认为美国政府未能解决导致这种公害的两大主要问题是什么?__________________________________________________________________
(4)写出反应⑤的离子方程式,并指出该化学反应的意义。__________________________________________________________________
(5)1997年美国三位科学家因发现物质D具有多种生理学功能而荣获诺贝尔生理学或医学奖。请问:
①物质D是___________系统中传递信号的分子,在体内可松驰___________,有助于调节___________;
②治疗心绞痛的药物硝化甘油之所以具有___________的生理作用,是由于硝化甘油在人体体液中的酶作用下缓慢氧化自发释放出D分子,同时生成CO2、H2O,写出该氧化还原反应方程式。______________________。
一、选择题:(共44分)
1.D 2.A 3.D 4.B 5.A 6.D 7.C 8.C 9.A 10.C 11.B
12.D 13.B 14.A 15.C 16.C 17.A 18.B 19.A 20.C 21.B 22.B
二. 填空题(本题共4小题,共48分)
23.(8分,每空2分) K2Cr2O7 是氧化剂, HCl 是还原剂,
Cl 元素被氧化, Cr 元素被还原,
Cl2 是氧化产物, CrCl3 是还原产物。
 |
K2Cr2O7 +14HCl=2KCl+2CrCl3+3Cl2↑+7H2O(标出电子转移方向和数目)
24.(14分,每空2分)
(1)化学式:A Ba(OH)2 B H2SO
(2)反应①、②、⑤的离子方程式
① SO42-+ 2H++ ba2++2oh-= baSo4↓+2H2O
② CO32-+ 2H+ = CO2 ↑+ H2O
⑤ Mg2+ + 2oh- = Mg(OH)2↓
25.(14分,每空2分)三种离子: OH- 、 K+ 、 Cl- 。
铁粉 , 银 ,
Ag+ 、 Fe3+ , NO3- 、 K+ 。
26.(12分,每空2分) (1)
(2)500mL容量瓶、烧杯、玻璃棒、胶头滴管。
(3)A、_无影响____ B、____偏高_
C、__偏低____ D、 _偏低_ 。
三. 计算题(本题共1小题,共8分)
27.(1)氧化剂是 MnO2 (2分 )
(2) ①168mL(3分 )
②1mol (3分 )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com