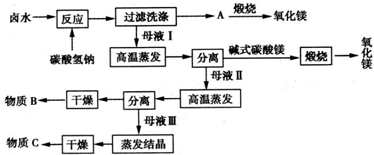
肉桂酸主要用于制备酯类,还用作植物生长促进剂、长效杀菌剂.苯甲醛和乙酸酐在碱性催化剂(如无水K
2CO
3)作用下,生成肉桂酸,方程式如下:
C
6H
5CHO+(CH
3CO)
2O?C
6H
5CH=CHCOOH+CH
3COOH
有关数据如下表:
| 物质 |
(CH3CO)2O |
C6H5CHO |
C6H5CH=CHCOOH |
CH3COOH |
| 沸点 |
139℃ |
179℃ |
300℃ |
117.9℃ |
实验室制取肉桂酸的步骤如下:
①在250mL三颈烧瓶中,加入7g无水K
2CO
3,5mL苯甲醛和14mL醋酸酐,电热套加热(或用油浴加热)回流45min(如图一,冷凝管可不通冷凝水).
②稍冷后,加入20mL水,缓慢加入适量固体碳酸钠,使溶液呈微碱性.进行水蒸气蒸馏(如图二),直到无油状物蒸出为止.
③水蒸气蒸馏残留液加入少量活性炭,煮沸数分钟趁热过滤,在搅拌下往热滤液中加入浓盐酸至呈酸性.
④冷却,过滤,用少量冷水洗涤产物,产物在空气中晾干,称重,计算产率.

回答下列问题:
(1)在肉桂酸的制备中,水蒸气蒸馏的目的是
为了蒸出苯甲醛
为了蒸出苯甲醛
.
(2)在肉桂酸制备实验中,为什么要缓慢加入固体碳酸钠来调节pH值?
若加入碳酸钠的速度过快,易产生大量CO2的气泡,而且不利于准确调节pH值
若加入碳酸钠的速度过快,易产生大量CO2的气泡,而且不利于准确调节pH值
.
(3)用少量冷水洗涤产物的目的:
提纯,洗去固体表面的杂质离子,同时用冷水是为了减少固体因溶解带来的损失
提纯,洗去固体表面的杂质离子,同时用冷水是为了减少固体因溶解带来的损失
.
(4)在浓强碱存在下,C
6H
5CHO发生反应:2C
6H
5CHO+KOH(浓)→C
6H
5COOK+C
6H
5CH
2OH反应类型为:
氧化还原反应
氧化还原反应
.
(5)写出苯甲醛和丙酸酐[(CH
3CH
2CO)
2O]在无水K
2CO
3存在下,发生的反应的化学方程式:
.