
题目列表(包括答案和解析)
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中、断裂键的说法不正确的是
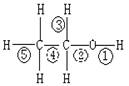
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇制乙烯时,键②⑤断裂
D.在铜催化下和O2反应,键①②断裂
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中、断裂键的说法不正确的是
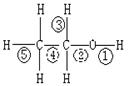
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇制乙烯时,键②⑤断裂
D.在铜催化下和O2反应,键①②断裂
乙醇分子中不同的化学键如右图关于乙醇在各自种不同反应中断裂键的说明不正确的是:
A、和金属钠反应产,键①断裂
B.在Cu催化下和O2反应,键①③断裂
C.和乙酸发生酯化反反应时,键②断裂
D.和浓硫酸共热170℃时,键②⑤断裂
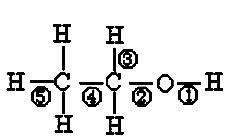
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中、断裂键的说法不正确的是
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇制乙烯时,键②⑤断裂
D.在铜催化下和O2反应,键①②断裂
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中、断裂键的说法不正确的是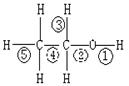
| A.乙醇和钠反应,键①断裂 |
| B.在铜催化下和O2反应,键①③断裂 |
| C.乙醇制乙烯时,键②⑤断裂 |
| D.在铜催化下和O2反应,键①②断裂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com