
题目列表(包括答案和解析)
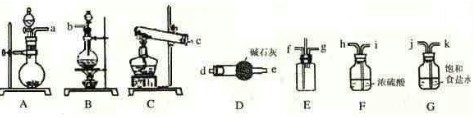
| ||
| ||
| 辅助试剂 |
| 加热 |
| NaOH溶液 |
| 吹出 |
| H3BO3 |
| 吸收 |

| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积/mL |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 25.50 |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 4 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 5 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 1.50 |
 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空: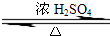 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O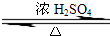 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(12分)本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是 ;其基态原子的
电子排布式为 。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。

(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为 ,与CN一互为等电子体的单质的分子式为 。
B.某课题小组同学测量液态奶含氮量的实验过程如下:

步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
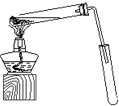
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
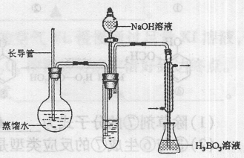
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:

回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为 。
(2)步骤③的实验装置中需要加热的仪器是 (填仪器名称),长导管的作用是 。
(3)不做空白对照实验对实验结果有何影响 (填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是 mL,该液态奶的含氮量 mg·mL-1。
 (NH4)2SO4溶液
(NH4)2SO4溶液 NH3
NH3 (NH4)2B4O7
(NH4)2B4O7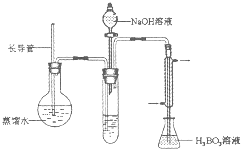
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积/mL |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 25.50 |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 4 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 5 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 1.50 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com