
题目列表(包括答案和解析)
(10分)下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
![]() ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是![]() 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为![]() ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
(10分)下图是一个电化学过程的示意图。

请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O
 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是 ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为 ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |


| ||
| ||
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | F | Na | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
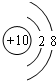
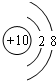
 代表氢原子代表
代表氢原子代表  碳原子),
碳原子),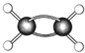 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=
| ||
| ||
(8分)下表是元素周期表的一部分,根据所给元素,用元素符号或化学式回答下列问题。
(1)非金属性最强的元素是 ;
(2)Ne 原子结构示意图为 ;
(3)C 与N 中,原子半径较小的是 ;(4)氯水具有漂白作用,是由于其中含有 ;
(5)元素最高价氧化物对应的水化物中,碱性最强的是 ,呈两性的是 ;
(6)镁是制造汽车、飞机、火箭的重要材料。写出工业上电解熔融
氯化镁获得金属镁的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com