
题目列表(包括答案和解析)
| |||||||||||||||

实验步骤:
(1)把30% NaOH溶液和废铁屑混合、煮沸、冷却,用清水洗净废铁屑。将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
试回答下列问题:
(1)F中的NaOH溶液的主要作用是____________________________________________。
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞______________,并同时打开活塞______________。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用____________________________。
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液,再自然冷却结晶;②不蒸发溶液,直接自然冷却结晶。你认为较好的方法是______________。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
_______________________________________、______________________________________。
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
 (1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
写出滤渣B中发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、
(填操作名称)、自然干燥。
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO。
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为 (填序号);证明铁红中含有FeO的实验现象为 。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为 。
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
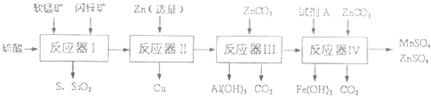
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com