
题目列表(包括答案和解析)
 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
|
化学键 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
|
键能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是 kJ·mol
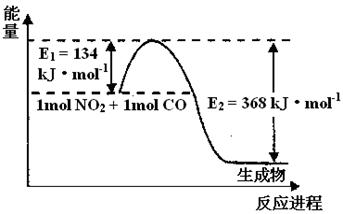
(2) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图如下,请写出NO2和CO反应的热化学方程式
(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l);ΔH =
(用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式__________________ __________。
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H=+ 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
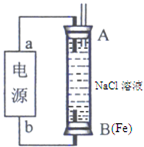
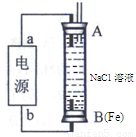
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为 极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是 (填化学式),B电极上的电极反应式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为 。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正) v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是 。
(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是 kJ·mol
(2) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图如下,请写出NO2和CO反应的热化学方程式
(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g)+ 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g) + 2H2O(l);ΔH =
(用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式__________________ __________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com