
题目列表(包括答案和解析)
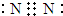
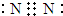
| ||
| △ |
| ||
| △ |
Q、R、X、Y、Z为短周期元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,R与Y原子的价电子数之比为2∶3,Y和Z的阴离子与Ar原子的电子层结构相同且Y的原子序数小于Z。
(1)工业上用Q单质与R的氧化物制备单质R,反应的化学方程式是 。
(2)R的氢化物分子空间构型是正四面体,属于________分子(填“极性”或“非极性”);R与X形成的化合物可作为一种重要的高温结构陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是_____________。
(4)Y与Z可形成极性分子YZ2,该分子的电子式是________________。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z元素的正三价离子的3d轨道为半充满,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z元素基态原子的外围电子排布式为___________________。
(2)五种元素中,电负性最大与最小的两种非金属元素形成的物质的化学式为 。(3)Q、R、X 三种元素的第一电离能数值由小到大的顺序为 。(用元素符号作答)
(4)Z元素的正三价离子的硝酸盐水溶液显 性,试用离子方程式解释其原因: 。
(5)Q的一种氢化物组成18电子的分子,其化学式(分子式)为 。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z元素的正三价离子的3d轨道为半充满,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z元素基态原子的外围电子排布式为___________________。
(2)五种元素中,电负性最大与最小的两种非金属元素形成的物质的化学式为 。(3)Q、R、X 三种元素的第一电离能数值由小到大的顺序为 。(用元素符号作答)
(4)Z元素的正三价离子的硝酸盐水溶液显 性,试用离子方程式解释其原因: 。
(5)Q的一种氢化物组成18电子的分子,其化学式(分子式)为 。
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素;②Y原子价电子排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z的元素符号为________,在周期表中的________分区.
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有________(填序号).
A.配位键
B.极性共价键
C.非极性共价键
D.离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是________.Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________(填序号).
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为________.R、X、Y四种元素的原子半径由小到大的顺序为________(均用元素符号表示).
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com