
题目列表(包括答案和解析)
[s1] (探究创新题)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
请根据以下实验事实逐步推出它们的名称并回答问题:
(1)
| 物质鉴定实验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为________,C、D、E中含有的阳离子为______________ |
| ②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 | A为________, C含________离子 |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为________ |
(2)写出E溶液与过量的B溶液反应的离子方程式:
_______________________________________________________。
(3)在100 mL 0.1 mol/L的E溶液中,逐滴加入35 mL 2 mol/L NaOH 溶液,最终得到沉淀的物质的量为________________。
[s1]16.
[s1] (探究创新题)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
请根据以下实验事实逐步推出它们的名称并回答问题:
(1)
|
物质鉴定实验 |
推导结论 |
|
①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 |
A、B中含有的阴离子为________,C、D、E中含有的阳离子为______________ |
|
②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 |
A为________, C含________离子 |
|
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 |
D为________ |
(2)写出E溶液与过量的B溶液反应的离子方程式:
_______________________________________________________。
(3)在100 mL 0.1 mol/L的E溶液中,逐滴加入35 mL 2 mol/L NaOH 溶液,最终得到沉淀的物质的量为________________。
[s1]16.


(创新题)做一个家庭小实验:
(1)将蜡烛点燃,并燃烧几秒钟,等火焰稳定后,在其上方撒下小苏打粉末,火焰会出现什么现象?
(2)不慎将食盐水洒在煤气灶上,观察火焰的颜色。
解释上述两实验现象产生的原因。
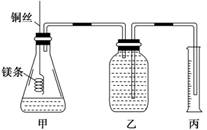 |
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com