
题目列表(包括答案和解析)
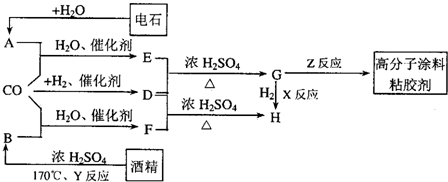
| 催化剂 |
| 浓硫酸、△ |
| 催化剂 |
| 催化剂 |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
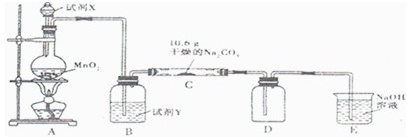
| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤l:取c中的少量固体样品于试管中,滴加足量蒸馏 水至同体溶解,然后将所得溶液分别置于a、b试管中. |
无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加适量BaCl2溶液 向A试管中滴加适量BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
(1)将仪器连接好以后,必须进行的第一步操作是________________。
(2)此实验还必须用到的最重要的仪器是_______________;仪器F的作用是______________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中_______________,D中__________________,E中__________________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值________(填“偏高”“偏低”或“没影响”)。
(5)若仪器E在实验完成时增重
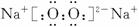
图1-3-19
其中A和G的摩尔质量相等,且A为含非极性键的离子化合物;B在常温下是液态化合物;D是双原子气体单质;H是常见金属。
(1)A的电子式:___________。
(2)H和C溶液反应的化学方程式为___________。其中氧化剂是___________。
(3)用离子方程式表示E的水溶液呈碱性的原因___________。
(4)在E溶液转化为G的⑤反应中,最好选用下列哪种试剂___________,其理由是_____________________________________________________________________。
A.稀盐酸 B.CO2 C.氨水 D.NaOH溶液 E.H2O
(5)若H与金属镁用导线连接后插入C溶液中可以构成原电池,写出负极的电极反应式:___________。
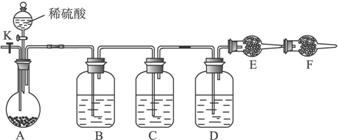
(12分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是___________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是____________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷 i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是______________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为__ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com