
题目列表(包括答案和解析)
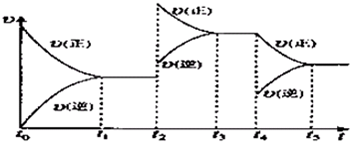
| 15 | 16 |

完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热__________装置,原因是_______________;
(2)D装置中应填充的物质是__________,该物质的主要作用是______________________;
(3)E装置的作用是__________,F、G装置中的物质分别是_____________,__________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。

完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是______________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是__________________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是____________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。


回答下列问题:
(1)写出A中反应的化学方程式_________________,实验时,A、C两装置均需加热,应先加热_________________装置,原因是__________________________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是________________________。
(3)E装置的作用是_________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com