
题目列表(包括答案和解析)
| 实验编号 | 1 | 2 | 3 |
| 消耗Na2S2O3体积/mL | 26.90 | 27.00 | 26.96 |
(1)(5分)现有五种有机物:
A.CH2=CH2 B.CH3CHO C.CH3COOCH2 CH3 D.![]()
请选择正确答案的字母填在相应的空格里。
在加热条件下,可与新制Cu(OH)2反应生成砖红色沉淀的是 ;能发生水解反应的是 ;可发生加聚反应的是 ;以使FeCl3溶液显紫色的是 ;可用于制取TNT炸药的有机物是 。
(2)(7分)石油裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产化工产品的转化关系图。

填写下列各空:
①CH2=CH2→B的反应类型(填“取代反应”或“加成反应”): 。
②A的结构简式: 。
③B+C→D反应的化学方程式: 。
④区别乙烯和乙烷时,可将两种气体分别通入 中,观察溶液是否褪色。
(3)(3分)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯的合成路线如下:
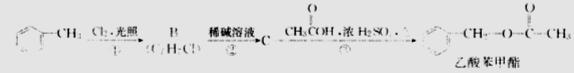
反应③的化学方程式为 ;乙酸苯甲酯有很多同分异构体,请写出一种含有苯环且苯环连有羟基和醛基的同分异构体的结构简式: 。
与主族元素在周期表中所处的位置有关的是( )
A.相对原子量 B. 核内中子数 C.次外层电子数 D. 电子层数和最外层电子数
【解析】元素在周期表中的位置是由元素原子的核外电子排布决定的。主族元素的最外层电子数是1~7,0族是2或8,副族及第Ⅷ是1或2。所以正确的答案是D。
(7分)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(写出最佳答案)。
(1)沉淀的化学式:
沉淀1________________,沉淀 2________________,沉淀3________________;
2________________,沉淀3________________;
(2)写出混合液+A的离子方程式: ____ ______
溶液1+B的离子方程式:_ ______ ___。
______ ___。
与主族元素在周期表中所处的位置有关的是( )
A.相对原子量 B. 核内中子数 C.次外层电子数 D.电子层数和最外层电子数
【解析】元素在周期表中的位置是由元素原子的核外电子排布决定的。主族元素的最外层电子数是1~7,0族是2或8,副族及第Ⅷ是1或2。所以正确的答案是D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com