
题目列表(包括答案和解析)
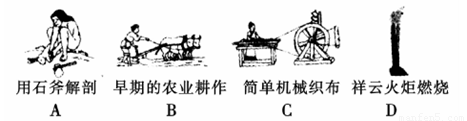
(1)下列生产、生活的事例中发生了氧化还原反应的是 。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
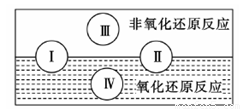
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:
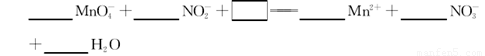
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是 。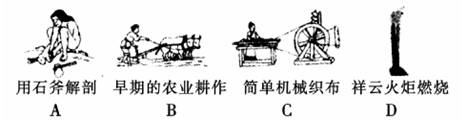
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。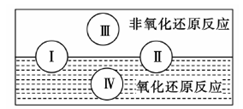
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是: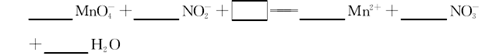
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应: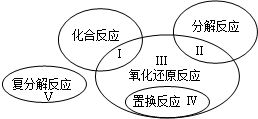
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH 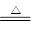 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水 (填字母)。
| A.是氧化剂 |
| B.是还原剂 |
| C.既是氧化剂又是还原剂 |
| D.既不是氧化剂又不是还原剂 |

| ||
| ||
(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO  N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
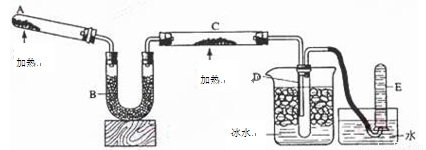
(1)A中发生反应的化学方程式是 。
检验氨气通常采用的方法是________ _,其现象是__ ________。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是 ,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,(一种类似于U型管作用,内装固体干燥剂的管子)第一个干燥管X内装有______,现象是_______;第二个干燥管Y内装有碱石灰,作用是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com