
题目列表(包括答案和解析)
HO—CH2—CH2—OH![]()
HO—CH2CH2—O—CH2CH2—OH![]()
HO—CH2CH2—O—CH2CH2—O—CH2CH2OH ![]()
(1)以![]() 的形式表示上述一系列醇醚的结构简式:__________________。
的形式表示上述一系列醇醚的结构简式:__________________。
(2)写出上述同系列的分子式通式:________________
(3)推算该同系列化合物中碳元素的质量分数最大值为__________________。
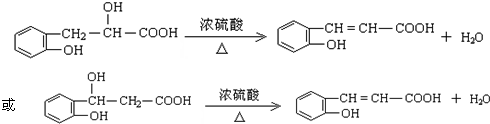
如果定义有机物的“同系列”是一系列结构式符合A![]() B(其中n=1.2……)的化合物.其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差.环氧乙烷
B(其中n=1.2……)的化合物.其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差.环氧乙烷![]() 与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚.其反应原理可表示为:
与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚.其反应原理可表示为:
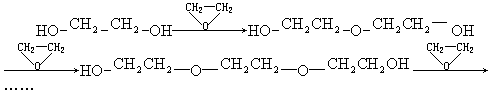
(1)以A![]() B的形式表示上述一系列醇醚的结构简式________;
B的形式表示上述一系列醇醚的结构简式________;
(2)写出上述同系列的分子式通式________;
(3)推算该同系列化合物中碳元素的质量分数最大值为________.
研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。
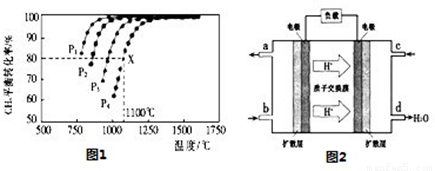
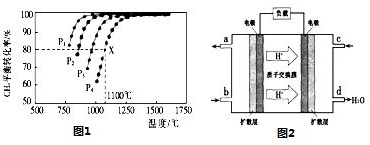
(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是 。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 。
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从 (填“c或一b”)口通人,电池负极反应式为 ,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为 。
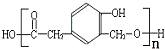 )和某合成鞣剂(
)和某合成鞣剂( 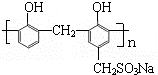 )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):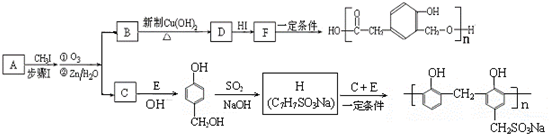
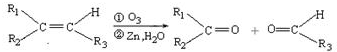 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)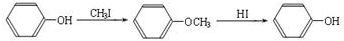





 ,X的结构简式为
,X的结构简式为


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com