
题目列表(包括答案和解析)
阳极反应式:2CO+2![]()
![]() 4CO2+4e-
4CO2+4e-
阴极反应式为_____________________,总电池反应为_______________________、还原剂是________________。
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2![]()
![]() 4CO2+4e-
4CO2+4e-
阴极反应式为_____________________,总电池反应为_______________________、还原剂是________________。
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2![]() →4CO2+4e-
→4CO2+4e-
阴极反应式为________,总电池反应为________、还原剂是________.
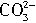
 的物质的量在工作时保持不变
的物质的量在工作时保持不变 O2(g)=CO(g)△H=-110.5kJ/mol
O2(g)=CO(g)△H=-110.5kJ/mol湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com