
题目列表(包括答案和解析)
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
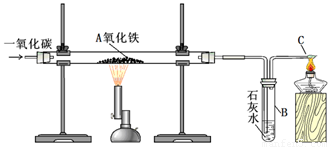
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中__ _____________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
|
实验操作 |
预期现象和结论 |
|
步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
|
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则
(2)若溶液变红色,则
|
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中_______________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
| 实验操作 | 预期现象和结论 |
| 步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 | (1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
| 步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 | (1)若溶液不变红色,则 (2)若溶液变红色,则 |
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程。
(一)结构分析
(1)写出乙醇的结构式 ;官能团的电子式 。
(二)性质预测
(2)对比乙醇和乙烷的结构,经过讨论,同学们认为乙醇分子中氧原子吸引电子能力较强,预测在一定条件下分子中 键(填写具体共价键)容易发生断裂。为此,他们查阅了相关资料,获得了以下乙醇性质的部分事实。
|
下列关于乙醇结构和性质的分析、理解错误的是
A.-OH对-C2H5的影响使乙醇与钠的反应比水与钠的反应速率慢ks5u
B. 乙醇在浓硫酸催化下,170℃时脱水生成乙烯的反应为消去反应
C. 乙醇的核磁共振氢谱图上有3个吸收峰,其强度之比为3︰2︰1,与钠反应的是
吸收强度最小的氢原子
 D. 乙醇与甲醚互为官能团异构体
D. 乙醇与甲醚互为官能团异构体
(三)设计方案、进行实验
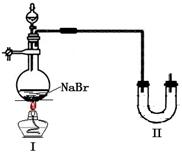
甲同学用4mL 95%的乙醇、8mL90%浓硫酸、
6g溴化钠研究乙醇转化为溴乙烷的反应。右图
是他设计的实验装置图(已省略部分夹持仪器)。
请回答有关问题。
(3)预计实验时装置Ⅰ主要发生两个反应,写出反应②的化学方程式。
![]() ①2NaBr + H2SO4 2HBr + Na2SO4,
①2NaBr + H2SO4 2HBr + Na2SO4,
②
(4)实验过程中,观察到反应后期烧瓶内液体颜色变棕黑,U形管右边与大气相通的导管口产生大量有刺激性气味的白雾,U形管内有少量淡黄色液体,该液体的有机成分是 。若要获得纯净的溴乙烷,方法是:实验结束后 。
(四)反思与改进
(5)乙同学认为:实验所用浓硫酸必须进行稀释,目的是 (填字母),稀释后的浓硫酸应放在 (填实验仪器名称)中。
A.减少HBr的挥发 B.防止浓硫酸分解产生SO2
C.减少副产物乙烯和乙醚的生成 D.减少Br2的生成
(6)丙同学提出应该对实验装置进行改进,请为两部分装置选择正确的措施:
A.不作改变 B.保留酒精灯加热,增加温度计且温度计水银球插入反应液中
C.水浴加热 D.冰水混合物冷却
装置Ⅰ ;装置Ⅱ 。请你再提出一条改进措施 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com