
题目列表(包括答案和解析)
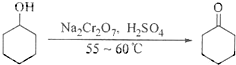
| 物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
三苯甲醇(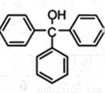 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
已知:i)格氏试剂容易水解,

ii)相关物质的物理性质如下:
|
物质 |
熔点(℃) |
沸点(℃) |
溶解性 |
|
三苯甲醇 |
164.2 |
380 |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
|
乙醚 |
—116.3 |
34.6 |
微溶于水,溶于乙醇、苯等有机溶剂 |
|
溴苯 |
—30.7 |
156.2 |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
|
苯甲酸乙酯 |
—34.6 |
212.6 |
不溶于水 |
|
Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
iii)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)实验室合成三苯甲醇的装置图2,写出玻璃仪器A的名称: ,装有无水CaCl2的仪器A的作用是: ;
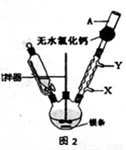
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是 ,微沸回流时冷凝管中水流的方向是: (填“X→Y”或“Y→X”);
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等 杂质,可以设计如下提纯方案,请填写空白:
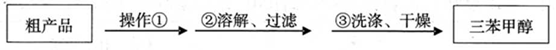
其中,操作①为: ;洗涤液最好选用: ;
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为: ;
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况)。产品中三苯甲醇质量分数为 (保留两位有效数字,已知三苯甲醇的分子式为C19H16O,相对分子质量为260)。
(14分)三苯甲醇(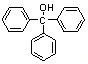 )是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
)是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。

图1
已知:(1)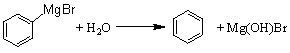 (碱式溴化镁);
(碱式溴化镁);
(2)相关物质的物理性质如下:
|
物质 |
熔点 |
沸点 |
溶解性 |
|
三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
|
乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
|
溴苯 |
-30.7°C |
156.2°C |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
|
苯甲酸乙酯 |
-34.6°C |
212.6°C |
不溶于水 |
|
Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:A ,导管B的作用 ;
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是 ,微沸回流时冷凝管中水流的方向是
(填“X→Y”或“Y→X”),装有无水CaCl2的仪器A的作用是 ;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白:


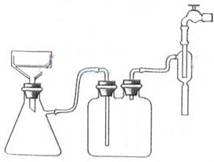
图2 图3
(4)抽滤时所用装置如图3所示,该装置存在的错误有 ,抽滤完毕或中途停止抽滤时的操作方法:应先 ,然后 ;
(5)洗涤液最好选用 ,检验产品已经洗涤干净的操作为 。
(A)水 (B)乙醚 (C)乙醇 (D)苯
B环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7 溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应
增多。实验中将酸性Na2Cr2O7 溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7 溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4 固体,除去有机物中的少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl 固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学
环境的氢原子。
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
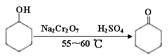
环己醇、环己酮和水的部分物理性质见下表:
|
物质 |
沸点(℃) |
密度(g·cm-3,20 ℃) |
溶解性 |
|
环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
|
环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
|
水 |
100.0 |
0.9982 |
|
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。
实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156 ℃馏分
b.过滤
c.在收集到的馏分中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是 。(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com