
题目列表(包括答案和解析)
| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成-个小球,在水面上无定向移 动,随之消失,溶液变红色. |
1 | |
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 | |
| 3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 | |
| 4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 | |
| 5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 | |
| 6.向AlCl2溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 | 6 | |
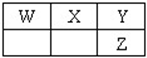 如图是元素周期表主族元素的一部分.短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.下列说法正确的是( )
如图是元素周期表主族元素的一部分.短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.下列说法正确的是( )A、Z的元素符号是S,原子结构示意图为 | B、W、X、Y、Z的气态氢化物的稳定性依次减弱 | C、W、X、Y的最高价氧化物对应水化物的酸性依次增强 | D、Y有两种常见的同素异形体,化学式分别为Y2与Y3 |

| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 1 |
| 2 |
| 3 |
| 2 |
| A、对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | B、氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | C、合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | D、25℃Ksp[Al(OH)3]=2×10-33,Ksp(AlPO4)=1.310-20,在各自的饱和溶液中,c(Al3+)前者小 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com