
题目列表(包括答案和解析)
(13分)已知某氯代烃A的相对分子质量为113,且氯的质量分数是62.8%,A进行核磁共振氢谱分析,谱图中只有两组峰。
(1)A的分子式是_________________________
(2)A有如下的转化关系:
①C中的官能团名称是______________;C可以发生的反应有________________。
a.与氢气加成 b.缩聚反应 c.中和反应 d.水解反应 e.取代反应
②D的结构简式为:________________。
(3)巴比妥是一类重要的有机物,其中一些常常可用作镇静和催眠的药物,其结构简式如右图所示,R、R’为烃基或氢原子。
下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:
已知:
①写出E转化为F的化学方程式:_________________________________________。
②巴比妥H的结构简式是_____________________________。
③I有多种同分异构体,其中满足:i属于甲酸酯;ii能使溴的四氯化碳溶液褪色;iii结构中只有一个甲基的共有________种,写出其中任意一种:_________________。
(4)尿素(H2N-CO-NH2)也可与甲醛合成脲甲醛树脂,其可用于耐水性和介电性能要求不高的制品,如插线板、日用品、装饰品,也可用于部分餐具的制造。反应过程如下:
第一步生成聚合前体:
酸性条件:H2N-CO-NH2 + 2HCHO HOCH2NH-CO-NHCH2OH
碱性条件:H2N-CO-NH2 + 4HCHO (HOCH2)2N-CO-N(CH2OH)2
第二步聚合:
第一步反应得到的聚合前体继续在酸性或碱性条件下发生缩聚反应。
①第一步生成聚合前体的反应属于_________反应;要得到体型的脲甲醛树脂,尿素与甲醛需要在_________(填“酸性”或“碱性”)条件下反应。
②写出由酸性条件下得到的聚合前体通过醚键缩聚得到脲甲醛树脂的化学方程式:
____________________________________________________________________________。
已知A的分子式为C4H8O2,它与NaOH溶液发生反应的产物有如下转化关系。
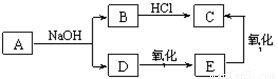
下列说法不正确的是( )
A.A结构简式为CH3COOCH2CH3
B.E的分子式为C2H6O
C.A在NaOH溶液中发生取代反应
D.C滴入NaHCO3溶液中有气泡生成
已知A的分子式为C4H8O2,它与NaOH溶液发生反应的产物有如下转化关系。
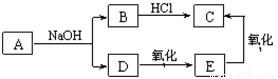
下列说法不正确的是
A.A结构简式为CH3COOCH2CH3 B.E的分子式为C2H6O
C.A在NaOH溶液中发生取代反应 D.C滴入NaHCO3溶液中有气泡生成
已知A的分子式为C4H8O2,它与NaOH溶液发生反应的产物有如下转化关系。 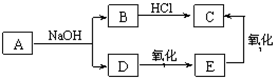
下列说法不正确的是
| A.A结构简式为CH3COOCH2CH3 | B.E的分子式为C2H6O |
| C.A在NaOH溶液中发生取代反应 | D.C滴入NaHCO3溶液中有气泡生成 |
(13分)已知某氯代烃A的相对分子质量为113,且氯的质量分数是62.8%,A进行核磁共振氢谱分析,谱图中只有两组峰。
(1)A的分子式是_________________________
(2)A有如下的转化关系:

①C中的官能团名称是______________;C可以发生的反应有________________。
a.与氢气加成 b.缩聚反应 c.中和反应 d.水解反应 e.取代反应
②D的结构简式为:________________。
(3)巴比妥是一类重要的有机物,其中一些常常可用作镇静和催眠的药物,其结构简式如右图所示 ,R、R’为烃基或氢原子。
,R、R’为烃基或氢原子。
下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:

已知:
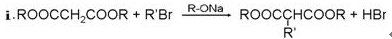

①写出E转化为F的化学方程式:_________________________________________。
②巴比妥H的结构简式是_____________________________。
③I有多种同分异构体,其中满足:i属于甲酸酯;ii能使溴的四氯化碳溶液褪色;iii结构中只有一个甲基的共有________种,写出其中任意一种:_________________。
(4)尿素(H2N-CO-NH2)也可与甲醛合成脲甲醛树脂,其可用于耐水性和介电性能要求不高的制品,如插线板、日用品、装饰品,也可用于部分餐具的制造。反应过程如下:
第一步生成聚合前体:
酸性条件:H2N-CO-NH2 + 2HCHO  HOCH2NH-CO-NHCH2OH
HOCH2NH-CO-NHCH2OH
碱性条件:H2N-CO-NH2 + 4HCHO  (HOCH2)2N-CO-N(CH2OH)2
(HOCH2)2N-CO-N(CH2OH)2
第二步聚合:
第一步反应得到的聚合前体继续在酸性或碱性条件下发生缩聚反应。
①第一步生成聚合前体的反应属于_________反应;要得到体型的脲甲醛树脂,尿素与甲醛需要在_________(填“酸性”或“碱性”)条件下反应。
②写出由酸性条件下得到的聚合前体通过醚键缩聚得到脲甲醛树脂的化学方程式:
____________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com